|
Los senderos de la Inmunidad
Dr. Roberto Maino
Iniciamos hoy un intento de traer a la Revista un relato de los complejos mecanismos que dan como resultado el que se reconozca en el sistema inmunitario a una organización de células y moléculas con un destino común que es el de defender a los organismos vivos de la infección.
A poco de andar se perciben claros indicios de que esta intrincada vía tiene lazos con la sobrevida misma de la especie y al mismo tiempo con la evolución de los distintos organismos vivos que los investigadores creen poder atisbar en los resultados de los estudios genéticos.
Como ya citáramos en otra comunicación anterior1, 430 años antes de nuestra era, Tucídides, un
general griego, notó la aparición de inmunidad natural en las víctimas de la plaga que azotaba a Atenas en ese momento y así escribió en su historia de las guerras del Peloponeso "Nadie contrajo la enfermedad por segunda vez en su vida".
También los chinos, hacia el año 1000, dejaron anotado en sus archivos la inoculación de una persona con material de una vesícula obtenida de una pústula de un paciente que padecía viruela en forma leve y Mary Wortley de Montagu, esposa del embajador británico en Turquía, en 1721 decidió efectuar la primera variolización "occidental" en su hija de tres años de acuerdo a lo observado que se efectuaba en aquel país.
Pero la medicina ha fijado en el 1º de julio de 1796 la fecha del nacimiento de la inmunología, fue el momento en que Eduardo Jenner expuso al virus de la viruela a James Phipps un niño de alrededor de 10 años al que había "vacunado" seis semanas antes con material de una pústula que extrajo de la mano de Sarah Nilmes, ordeñadora de oficio, que había adquirido la infección de una vaca llamada Blossom de la que aún hoy se guardan sus ubres en el Hospital de San Jorge en Londres 2.
Recién 75 años más tarde Luis Pasteur introdujo por primera vez el término "inmune" e "inmunitario" en el sentido que hoy le damos a esas palabras.
Unos años más tarde, en 1890 el austríaco Emil von Behring y el investigador japonés Shibasaburo Kitasato descubrieron que la sangre de animales inmunizados para distintas enfermedades podían ser utilizados para proteger a otros animales, publicando el primero poco después, sus famosos trabajos "Report On Immunity Against Diphtheria and Tetanus" y "Blood serum which has developed immunity against diphtheria or tetanus exerts an antitoxic effect on the toxin in the infected orga-nism" que le valieron en 1901 el obtener el primer premio Nobel en medicina y ser reconocido como el "Salvador de los niños" por la aplicación del suero antidiftérico, introduciendo por primera vez el término "antitoxina" para definir a la sustancia que neutralizaba a la toxina diftérica.
Siempre basados en la observación clínica metódica y sistemática fueron apareciendo términos como el de "alergia" acuñado por Clemens von Pirquet, creador en 1909 del test clásico de diagnóstico con tuberculina aplicada sobre una abrasión dérmica en el brazo, Pirquet, pediatra, un verdadero genio de la medicina, en 1906 notó que los pacientes que recibían suero de caballo como vacuna contra la viruela, desarrollaban una reacción mucho más severa a una segunda inyección, acuñó entonces junto a otro extraordinario observador, Bela Schick, el término "alergia" derivado del griego
"allos" cambio o alteración y "ergon" reacción o reactivado, que designa desde entonces a los cambios que se producen en la inmunidad de un organismo frente al contacto con una sustancia extraña.
Durante las siguientes décadas y hasta más allá de la mitad del siglo XX, cada paso en el progreso del conocimiento en el campo de la inmunología fue el resultado de calculados razonamientos de clínicos o patólogos, hasta que en 1954, Barnes y Loutit3 describieron la enfermedad de injerto versus huésped (EIVH) en el ratón y en 19574 Simonsen en Dinamarca introdujo el término de "reacción de injerto vs huésped" describiendo el daño inmunológico que provoca la introducción de células inmunocompetentes en un huésped inmunocomprometido, así como Billigham en 19665 en la Universidad de Pennsylvania publicó las condiciones exigidas para el desarrollo de la enfermedad.
A partir de ese momento la investigación pasó a estar en manos de los laboratorios de biología experimental produciéndose una verdadera catarata de datos los que fueron aclarando los conceptos hasta el momento actual para llegar a darnos una visión bastante distintiva de las líneas celulares y los innumerables productos biológicos y procesos que intervienen en una reacción inmunológica.
Plan general. Las barreras estratégicas.
Los médicos reconocemos desde hace mucho dos tipos diferentes de respuesta inmunitaria frente a una agresión microbiana, la respuesta natural o innata y la respuesta adaptativa o adquirida, pero en realidad existe una tercera barrera la física y primordial que está compuesta por la piel y las mucosas, recién cuando este primer escollo es sobrepasado se comienzan a desarrollar las otras dos secuencias.
En este nivel mecánico de defensa sólo la rotura de algún elemento, piel o mucosa, permite la invasión, la que deberá enfrentarse además con elementos disuasivos tales como sustancias antibacterianas que impiden la proliferación como la lisozima, la lactoferrina, el pH bajo de la secreción gástrica, la prevención de la estasis como el peristaltismo intestinal, el flujo urinario, la tos, los vómitos y en especial el clearence mucociliar 6 en el tracto respiratorio, que es un importante mecanismo de defensa contra patógenos inhalados merced a sus rápidos movimientos que en una manera coordinada expelen las partículas atrapadas en la capa mucosa de la faringe.
La respuesta innata presente desde el nacimiento está basada en el accionar de tres tipos celulares con funciones distintas que responden con la misma intensidad, independiente de la cantidad de veces que se encuentren con el agente infeccioso, por lo tanto, no mejoran ni empeoran su accionar a través de las subsiguientes exposiciones al antígeno; estos tipos celulares son:
a) los fagocitos
- neutrófilos,
- monocitos
- macrófagos
b) las células liberadoras de mediadores infla-matorios
- basófilos,
- mastocitos
- eosinófilos
c) las células natural killer
Además de las células que intervienen en la respuesta inmune innata, también lo hacen componentes moleculares, que son en definitiva productos biológicos producidos por distintas células de la economía7, y ellos son por ej.
· el complemento,
· las proteínas de fase aguda y
· las citoquinas como el interferón.
En este punto, aunque parece un poco desviado de nuestro propósito de referirnos a la reacción inmunitaria innata, es importante considerar a la respuesta de fase aguda (y a la inflamación)
como un proceso homeostático dinámico que involucra a todos los sistemas mayores del organismo, además del sistema inmunitario, el cardiovascular y el sistema nervioso central. Un aspecto importante de la respuesta de fase aguda es el perfil bioquímico alterado de la función hepática.
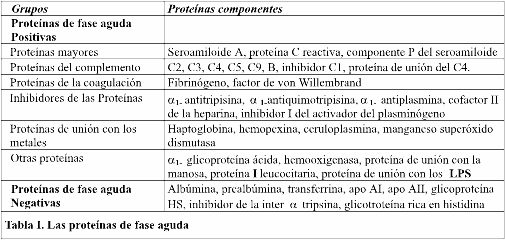
Normalmente, el hígado sintetiza una cantidad importante de proteínas con concentraciones casi siempre estables en sus niveles plasmáticos y dentro del líquido intercelular. Muchas de estas proteínas tienen funciones importantes, pero durante la respuesta de fase aguda que sigue a un estímulo inflamatorio se producen en el plasma niveles mucho más altos de estos reactantes de la fase agudos (RFA) o también denominados en forma indistinta proteínas de fase aguda (PFA).
Aunque la mayoría de los RFA son sintetizados por los hepatocitos, algunos son producidos por otros tipos de células como los monocitos, las células del endotelio, los fibroblastos y aun los adipocitos. La mayoría de los RFA aumenta entre un 50% hasta varias veces su valor y los exponentes mayores de esta familia de proteínas pueden aumentar hasta 1000 veces su valor normal cuando existe un estímulo inflamatorio.
En este grupo se incluyen la proteína C-reactiva que se une a los fosfolípidos de la membrana microbiana funcionando como una opsonina, la lectina de unión con la manosa, sustancia presente en muchas bacterias y hongos pero no en las células de los mamíferos, también funciona como una opsonina facilitando el pegamiento de los microorganismos a los fagocitos y activando la vía de las lectinas, además uno de los actores principales de este elenco lo constituyen las fracciones del complemento que son activadas como veremos luego por la acción de los TLR, promueven la inflamación, inducen la citolisis de la célula infectada y se constituyen en quemoatractivos de los fagocitos.
Por otro lado las así denominadas proteínas de fase aguda negativas disminuyen la concentración en el plasma durante la respuesta de fase aguda para permitir un aumento en la capacidad del hígado para sintetizar los RFA. Las proteínas de fase aguda de uno y del otro lado de la balanza se resumen en la
tabla 1.
Las citoquinas también forman otro grupo de sustancias que actúan como mediadores solubles del sistema inmunitario innato, actuando en forma indistinta como mensajero dentro del sistema inmunitario y entre éste y otros sistemas de los organismos vivos con los que forman una red integrada de acción. Las células tienen receptores específicos para las citoquinas. Junto con otros factores solubles, así como las moléculas de adherencia, las citoquinas contribuyen al reconocimiento de los patógenos, al reclutamiento de neutrófilos y mononucleares, y a la remoción de los patógenos invasores.
En este punto hay que remarcar que algunas citoquinas juegan un papel directo en cuanto se presenta un invasor, ejemplo de esto es cuando una célula infectada por un virus libera interferones que alertan y establece un sistema de defensa en las células circundantes, esta estrategia se está utilizando con éxito farmacológicamente en el tratamiento de algunas enfermedades como el melanoma en la que una combinación de interleuquina -2 e interferón - a 8 tiene aplicación en el tratamiento de esta afección. La respuesta adquirida en cambio, toma este nombre porque el sistema inmunitario requiere adaptarse para responder a moléculas hasta ese momento desconocidas y para ello necesita de la proliferación de células B específicas para el antígeno y además la intervención de las células T, lo que ocurre cuando los receptores de la superficie de estas células se ponen en contacto con el antígeno.
En este paso intervienen células especializadas llamadas células presentadoras de antígenos, las
que no sólo presentan los distintos componentes del antígeno9 a las células B y T sino que además colaboran con ellas en la respuesta final.
Las células B, luego de una serie de pasos que se enumeraran en la sección correspondiente, segregan anticuerpos específicos para cada antígeno, los que son los responsables de la eliminación de los microorganismos extracelulares. Las células T cooperan con las células B en la producción de anticuerpos y además pueden eliminar gérmenes intracelulares, lo que efectúan mediante la activación de los macrófagos y la muerte de las células infectadas por virus.
Todas estas células que hemos citado se desarrollan sin excepción a partir de las "Stem cells" o células progenitoras pluripotentes del hígado fetal pri-mero y de la médula ósea en la vida extrauterina, éstas que van evolucionando dentro de la médula encuentran su madurez en la misma médula en el caso de las células B, mientras en cambio las células T deben finalizar su desarrollo mediante un viaje a través del timo, aunque los dos tipos celulares recirculan constantemente desde la sangre, entrando y saliendo de distintos órganos donde reciben información y la trasladan.
La característica más importante del sistema inmunitario de los vertebrados lo constituye el hecho de que puede responder a cualquier sustancia que se una a los receptores de las células que pertenecen al sistema innato como al adquirido.
A las substancias que se unen a los linfocitos se las denomina antígenos, cualquiera sea ella, pudiendo su estructura ser enormemente variable, yendo desde pequeñas moléculas hasta estructuras muy complejas, y para reconocerlas los linfocitos poseen en la cara exterior de su membrana, pero empotrados en la misma y algunas con una prolongación hacia el citoplasma, estructuras que se denominan receptores, los que en el lado exterior están provistos de una pequeña cavidad destinada a adherirse a la estructura de la molécula de antígeno de la que sólo percibe una parte, a punto tal que esta superficie de adhesión puede llegar a tener no más de 600 A2.
El segmento que se une a la membrana linfocitaria es solo una parte de la molécula del antígeno y esa porción se denomina epítope antigénico o determinante antigénico, y debido a que la molécula antigénica suele ser mucho más grande, puede contener ella sola muchos epítopes antigénicos distintos los que conforman un mosaico de epítopes individuales.
Estos receptores están ubicados tanto sobre las superficies de las células T como las B, y cada célula presenta miles de receptores todos de la misma especificidad.
Los receptores de las células T (RCT) son capaces de unirse a las células que contienen a los antígenos y si las señales adicionales están presentes pueden activarse y responder al epítope específico presentado por otras células denominadas células presentadoras de antígenos (APC).
Los receptores de las células B (RCB) son capaces a su vez de unirse también a un epítope antigénico y por lo mismo si las señales están presentes pueden ser activadas y responder a antígenos solubles, momento en el cual la célula B secreta un gran número de los receptores también solubles y similares a los que posea en la membrana, estos son los anticuerpos.
tabla 1
La inmunidad innata. El sistema de alerta, las fuerzas de choque y las comunicaciones.
La habilidad de los organismos multicelulares para defenderse de la invasión de los otros predadores ya sean virus, bacterias, hongos, protozoarios o helmintos depende exclusivamente de su capacidad para reconocer a los invasores y de responder a ellos rápidamente desarrollando respuestas inmunes innatas.
Es indiscutible que el sistema inmune innato es más importante para la supervivencia que el sistema inmune adquirido; de hecho un vertebrado puede vivir sin linfocitos durante varios años, pero la ausencia de neutrófilos termina con su vida en pocas semanas.
La respuesta innata es propia a todos los organismos vivos, pero en particular los vertebrados disponen de un segundo
mecanismo que como dijimos constituye la inmunidad adaptativa o adquirida.
Figura 1 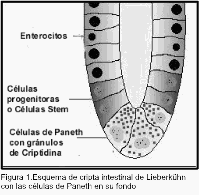
Durante la evolución el sistema innato apareció antes que el adaptativo, de manera tal que muchos de los mecanismos innatos existen en todos los organismos multicelulares, pero por otro lado la respuesta innata está mediada por la línea germinal, lo que significa que la producción de los receptores de sus células tienen que estar codificados en forma predeterminada en el genoma.
Para estar determinado en el genoma los genes productores debieron aparecer en el curso de la evolución y ahora sabemos que el genoma humano, apenas descifrado, contiene unos 75000 genes la mayoría de los cuales no tienen función inmunitaria, y se ha podido determinar que el número total de receptores de este tipo de inmunidad innata está solamente en el de algunos cientos10.
Los gérmenes patógenos tienen una composición extremadamente heterogénea, aun sin tener en cuenta su tremenda capacidad de mutación. Entonces la estrategia del sistema inmune innato no reside en reconocer cada estructura antigénica posible, sino que sólo reconoce unas pocas variantes que están presentes en forma general en todos los grupos de microoganismos.
Las características fundamentales de las respuestas inmunitarias innatas se las puede resumir de la siguiente manera.
1. Los patógenos son reconocidos por receptores codificados en la línea germinal (es decir que sus posibilidades están ya incluidas en el momento del nacimiento y no pueden ser modificadas con el devenir del tiempo).
2. Los receptores de las sustancias patógenas tienen una amplia especificidad, por ej. reconocen muchas estructuras moleculares relacionadas, a estas estructuras se las denomina PAMP (patentes moleculares relacionadas con los patógenos)
3. Los PAMP son esencialmente polisacáridos y polinucleótidos presentes en la constitución de los procariotas que difieren en muy pequeña escala de un patógeno a otro, es decir son relativamente invariables, pero con la característica de que esa estructura química no se la encuentra en el huésped.
4. Los receptores también lo son únicamente de reconocimiento de patentes.
5. La respuesta es inmediata en el mismo momento en que se establece el contacto con las sustancias PAMP.
6. No se establece una memoria del encuentro de manera tal que la respuesta posterior no se modifica.
Son ejemplo de estas moléculas cuya presencia son comunes en distintas familias de los invasores:
la flagelina, obviamente presente en los flagelados,
los peptidoglicanos que lo están en las bacterias gram positivas y
los lipopolisacáridos (LPS), que se en-cuentran en los gérmenes gram negativos.
los ácidos lipoteicoicos, de las membranas de las bacterias gram positivas,
la manosa de las levaduras,
los glucanos que forman parte de la membrana celular de los hongos.
También se incluyen dentro de los PAMP al genoma de doble hélice que contienen algunos virus con ARN y el de otros virus que contienen genoma con ARN que en la célula huésped es convertido en ARN de doble hélice.
Los grupos dinucleótidos CpG no metilados comunes en el DNA bacteriano pero casi ausentes en el DNA de los vertebrados.
Como se puede observar estas estructuras son químicamente muy distintas pero todos los patógenos tienen particularidades comunes:
1. Los PAMP son sólo producidos por los gérmenes y no por sus huéspedes.
2. Las estructuras que reconoce el sistema inmune innato son esenciales para la vida de los gér-menes.
3. Los PAMP son estructuras químicas compartidas por clases enteras de patógenos, por ejemplo los gérmenes gram negativos poseen todos, lipopolisacáridos en su constitución, por lo que los receptores de reconocimiento de patente de los huéspedes pueden detectar cualquier infección producida por cualquier germen gram negativo en forma genérica.
Además existen otras sustancias que segregadas por el organismo actúan ayudando al sistema innato y ellas son los denominados péptidos antimicrobianos, entre los que se destacan por haber sido los mejor estudiados las defensinas, las catelicidinas y las histatinas13.
Las defensinas se encuentran sobre todo en la piel, el tracto gastrointestinal y la mucosa del tracto genitourinario, la superficie de las mucosas nasal y de las vías aéreas superiores e inferiores.
Estas defensinas son segregadas por las células epiteliales y otras por los leucocitos, en especial los neutrófilos. Algunas de estas defensinas son segregadas en forma constante mientras que otras sólo aparecen como respuesta a la presencia de pató-genos, como veremos posteriormente también pue-den activarse por intermedio de los llamados receptores "toll" (TLR).
La función de las defensinas se ejerce sobre la membrana celular de los gérmenes provocando agujeros en ellas los que resultan finalmente fatales para el germen. Estos péptidos antimicrobianos se producen en forma de prepéptido y algunas de las seis formas conocidas de las defensinas se acumulan dentro de las granulaciones azurófilas de los granulocitos neutrófilos, constituyendo las proteínas principales de estos gránulos que luego contribuyen en los mecanismos de muerte de los microorganismos fagocitados.
En el árbol respiratorio por ejemplo, las dos funciones importantes de los epitelios de las vías aéreas son la producción de defensinas sodio-sensibles que se secretan en la luz de la vía aérea, y la producción de un líquido con bajo contenido de sodio (< 50 mM NaCl) en las superficies de la vía aérea que convierten a las defensinas en activas14.
Las catelicidinas son péptidos con función antibiótica que fueron aislados en las células mieloides de la médula ósea, pero también se las pudo identificar en la piel inflamada y en las vías aéreas en donde son vertidas en el líquido de la superficie de las mismas, lugar donde además recordemos que se detectan otras sustancias con actividad antimicrobiana como la lisozima, la lactoferrina, la fosfolipasa secretoria A2, el inhibidor de la proteasa leucocitaria secretoria además de los péptidos antimicrobianos que estamos citando.
La lisozima es muy activa contra muchas especies Gram-positivas, Bacillus megaterium, Micrococcus luteus y muchos streptococos, pero parece ser ineficaz contra las bacterias Gram-negativas a menos que sea potenciada por ciertos cofactores como la lactoferrina, los complejos anticuerpo-complemento, el peróxido de hidrógeno y el ácido ascórbico. Estos cofactores rompen la membrana exterior de las bacterias Gram-negativas probablemente y permiten que la lisozima acceda a la capa de peptidoglicano de la membrana que es sensible.
Las histatinas16 constituyen una familia de péptidos que están presentes en la saliva humana, todavía en fase de estudio, presentan una actividad antimicrobiana que incluye fuertes efectos antifúngicos.
Los péptidos antimicrobianos y el tracto gastrointestinal
El hecho de que los alimentos normalmente contienen microorganismos que no causan problemas luego de la ingestión es debido a la presencia de una barrera de péptidos antimicrobianos que recubre a la mucosa desde la boca hasta el ano, al respecto podemos enumerar:
a) El epitelio de la boca y la lengua están protegidos por los péptidos presentes en la saliva.
b) La mucosa del estómago lo está por la pepsina y por el pH muy bajo del jugo gástrico.
c) El contenido estomacal a su salida hacia el duodeno es rápidamente neutralizado por los iones bicarbonato del líquido pancreático del intestino delgado que actúan de manera tal que el líquido intestinal solo contiene una presencia muy disminuida de gérmenes.
d) Sin embargo, cualquier bacteria que sobreviva al viaje a través del estómago, (puede serlo por ejemplo la E. coli que tiene una bomba de protones que le permite sobrevivir a la presencia de la acidez gástrica), es atacada por los péptidos antimicrobianos segregados por las células de Paneth17, ubicadas en el fondo de las criptas de Lieberkühn en el intestino con funciones similares a los neutrófilos y vecinas de las Stem cells
(figura 1) a las que protegen, células "Stem" que están destinadas a renovar en forma constante el epitelio intestinal por la descamación que el mismo sufre.
Las principales moléculas segregadas por las células de Paneth son las alfa defensinas, también conocidas con el nombre de criptidinas, que poseen dominios hidrofóbicos con carga positiva que interactúan con los fosfolípidos de las membranas microbianas, en las que se insertan provocando poros que llevan a la muerte celular18, además las células de Paneth segregan también fosfolipasa A2 y lisozima que actúan en presencia de dipéptidos de muramil, lipopolisacáridos y lípidos A lo que le otorgan una gran potencia para actuar sobre bacterias, hongos y aun cápsulas virales.
En el colon y el recto se so-portan en cambio una enorme cantidad de microorganismos pero raramente invaden la mucosa debido a la cantidad de péptidos antimicrobianos que están presentes en ella.
Hasta aquí se han expuesto algunas de las estrategias generales que en las distintas situaciones impiden que el constante peligro de una inva-sión bacteriana irrumpa a través de las mucosas.
Los receptores de reconocimiento de patentes (PRR).
Para percibir la presencia de los elementos extraños relatados más arriba (PAMP) es necesario que existan detectores de las mismas, estos existen (PRR) y habitualmente se los divide en tres grupos pertenecientes a distintas familias de proteínas que como se explicó antes están codificados por la línea germinal:
· Moléculas segregadas
· Receptores endocíticos
· Receptores de señalamiento
1. Entre las moléculas segregadas que circulan libremente en la sangre y la linfa, se encuentran las fracciones del complemento, que luego de la activación inicial de C4 y C2 19 producen el clivaje del componente C3, que puede opsonizar (recubri-miento) al germen patógeno lo que permite una rápida fagocitosis.
Uno de los receptores mejor conocidos perte-neciente a esta familia es la lectina que se une a la manosa, esta proteína, que actúa como receptor, es sintetizada en el hígado y junto a las proteínas del surfactante forman parte de la familia de las colectinas20 llamadas así por su dominio cola-genoso unido al dominio lectínico calcio depen-diente y es al mismo tiempo parte de lo que conocemos como componentes de la respuesta de fase aguda.
La lectina de unión con la manosa es un miembro de la familia de lectinas calciodependientes, y es homóloga en su estructura a C1q21.
Estas proteínas se unen a los hidratos de carbono de la membrana de los gérmenes gram positivos y negativos, de los parásitos y de algunos virus, y como está asociada a dos serino proteasas con función similar a los componentes C1r y C1s del complemento, son capaces de clivar a la fracción C3 y provocar la activación de la C3 convertasa22 que activa la cascada del complemento.
2. Los receptores endocíticos de superficie situados en la membrana de las células fagocíticas (macrófagos) que se unen a los gérmenes patógenos que contienen repeticiones de polimanosa en su membrana (un polisacárido que los vertebrados no poseen) para luego incluirlas por endocitosis formando un fagosoma o lisosoma. Dentro del lisosoma las proteínas de la membrana celular del invasor son procesadas y reducidas a pequeños péptidos, los que luego como veremos son expuestos nuevamente en la superficie del macrófago por las moléculas del complejo mayor de histocompatibilidad. Otro receptor endocítico lo constituye el receptor de detritus celulares de los macrófagos que promueven la fagocitosis y tienen un papel muy importante en la defensa23.
3. La sobrevida de toda especie animal depende de su habilidad para reconocer rápidamente a los invasores. La respuesta innata identifica por medio de receptores de señalamiento a las macromoléculas de los patógenos por ej. como vimos recién arriba, los receptores de la manosa en los macrófagos se unen a las estructuras que contienen repeticiones de polimanosa. El CD14 (otro receptor) se une a ligandos lipídicos (lipopolisacáridos de los gram negativos, estreptococos y micobacterias TBC) pero este receptor CD14 que está anclado en la membrana por una pequeña cola glicosilfosfoinositol no tiene una cola intracitoplasmática que permita avisar a la célula fagocítica de la presencia del invasor, esto se hace por intermedio de una proteína circulante la proteína de unión con el lipopolisacárido que une a la molécula extraña con el CD14 y el próximo receptor TLR4.
Existen receptores en la superficie celular que uniéndose a los patógenos producen una señal que permite la liberación de moléculas efectoras, las citoquinas. Para esto los macrófagos, las células dendríticas y las epiteliales poseen un conjunto de receptores transmembranosos que reconocen a un tipo particular de sustancias PAMP, que se denomi- nan TLRs (Toll like receptors)24 por similitud con los identificados originariamente en la Drosófila25.
El lipopolisacárido microbiano (LPS) (figura
2) es un componente de la membrana de las bacterias gram negativas que se une con alta afinidad al CD14, una proteína fosfatidilinositol glicosilada que induce la asociación de TLR4 proteína de transmembrana con MD-2, que se expresa en la superficie de los macrófagos.
La señalización por la proteína LPS al complejo de transcripción regulador de NF - (kappa) B (factor nuclear kappa) y I (kappa) B ocurre a través de MyD88 (un factor de transcripción) y los receptores asociados a la interleuquina-1 quinasa 2 (IRAK2) e involucra al factor 6 de necrosis tumo-ral asociado (TRAF-6 ) y a la quinasa inductora del NF - (kappa)B, (NIK ).
Esta fosforilación de la quinasa I(kappa)B, ( IkB ) causa su degradación rápida y la descarga de NF-(kappa)B que entonces pasa al núcleo y lleva a la activación de la proteína TLR2 transmembranosa, iniciando una señal intracelular en cascada que induce la transcripción de las citoquinas
(figura 2 y 3).
figura 2 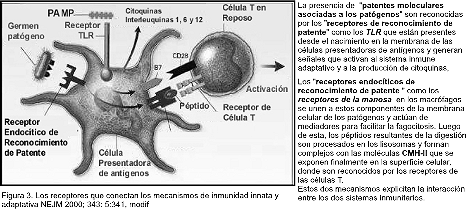
figura
3 
Los mamíferos poseen por lo menos diez diferentes moléculas de TLR cada una de las cuales se especializa en unirse a un tipo particular de PAMP.
Al respecto se sabe por lo menos que:
los TLR-2 se unen a los peptidoglicanos que se encuentran en la superficie de los estreptococos y los estafilococos;
los TLR-4 se unen a los lipopolisacáridos de las membranas de los gram negativos como las salmonellas y la E.coli O157:H7;
los TLR-5 se unen a las flagelinas de las bacterias móviles como la listeria y
los TLR-9 lo hacen con los grupos no metilados de CpG del ADN de los patógenos, promoviendo todos por el mecanismo arriba citado, la producción de citoquinas como en TNF-alfa (factor de necrosis tumoral alfa), la interleuquina-1 y distintas quemoquinas que atraen a los leucocitos con producción de la inflamación consiguiente.
Cerrando el anillo defensivo. El puente de unión entre la inmunidad innata y la adquirida.
Los receptores del sistema inmune innato son espe-cíficos para reconocer las estructuras que se encuentran exclusivamente en los gérmenes pató-genos, (PAMP), por lo que su función es la de señalizar la presencia de infección y además de su acción inmediata actuando con los elementos que dispone para neutralizar y matar al invasor, cumple también la función de activar al sistema inmunitario adaptativo para que este disponga su estrategia mucho más elaborada y específica de acción.
Este aviso puede efectuarse de diversas formas:
1. Los macrófagos y las células dendríticas son células fagocitarias que cumplen también la función de "presentar" los antígenos detectados a las células T para poder iniciar así tanto la respuesta mediada por células como la mediada por los anticuerpos y que son propias de la respuesta inmune adaptativa
Los fragmentos digeridos de los patógenos endocitados son vueltos a mostrar en la superficie celular encastrados en las moléculas de histocompatibilidad de clase II (CMH II).
Como relatáramos más arriba los genes de trans-cripción activados por la interacción de los PAMP con los TLR, provocan la aparición de proteínas transmembranosas en la superficie de los fagocitos que se las denominan B7 (también conocidas como CD80 y CD86) y que están siempre situadas muy próximas en la membrana celular a las del CMH II (figura 3).
Las células T tienen receptores para estas moléculas B7 que se denominan CD28.
La unión simultánea de CD28 con B7 y del CMH II con el TLR específico activa a la célula T.
Esta célula T activada entra en mitosis y produce clonos celulares de células T CD4+ que pueden activar, como veremos en capítulos posteriores, tanto la respuesta inmune mediada por células como estimular la secreción de anticuerpos de exacta especificidad.
2. Las células B son también células presentadoras de antígenos, mediante sus receptores de célula B (RCB) se unen al antígeno, lo ingieren colocándolo dentro de lisosomas y luego por un mecanismo similar al de los macrófagos y de las células dendríticas exponen a los péptidos resultantes de la digestión en la superficie de la membrana unidos al CMH II.
Es este el mecanismo que se invoca al incluir adjuvantes en las vacunas para aumentar su inmunicidad, los adjuvantes contienen PAMP lo que así estimula exageradamente la respuesta del sistema inmune adaptativo.
3. Los gérmenes opsonizados con la fracción C3 del complemento no solo sufren la fagocitosis sino que también provocan una unión mucho más fuerte con las células B y sus receptores RCB para la producción de anticuerpos de manera tal que estas células B producen grandes cantidades de anticuerpos neutralizantes, cerrando así el círculo del me-canismo inmunitario.
4. Es así que se completa el círculo por el que se intercomunican ambos sistemas inmunitarios: el innato a través del "señalamiento", "internación", "digestión", "presentación" y "comunicación" a las células T del sistema inmunitario adaptativo que promueven una respuesta secundaria mucho más elaborada, específica y de magnitudes crecientes ante los posteriores ataques del invasor.
Bibliografía
1 Prevención e inmunización". Medicina Interna. Revista de la Sociedad de Medicina Interna de Buenos Aires 2001;2(4):131-138
2 Rosen FS, Mackay I. The Immunology Series Comes to an End. N Engl J Med 2001; 345:1343-1344
3 Barnes DWH, Loutit JF: What is the recovery factor in spleen? Nucleonics 1954;12:68
4 Simonsen M. The impact on the developing embryo and newborn animal of adult homologous cells. Acta Path Microbiol Scand. 1957; 40: 480-500
5 Billingham RE. The biology of graft-versus-host reactions. Harvey Lect 1966-67;62:21-78
6 Knowles, M.R., and Boucher, R.C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 2002;109:571-577
7 Muller-Eberhard HG. Molecular organization and function of the complement system. Annu Rev Biochem 1988; 57:321-347
8 Keilholz U, Conradt C, Legha SS. Results of interleukin-2 based treatment in advanced melanoma: a case record-based analysis of 631 patients. J Clin Oncol 1998;16:2921-9
9 Fearon D, Locksley R. The intructive role of innate immunity in aquired immune response. Science 1996, 272:50-54
10 Medzhitov R, Janeway C. Advances in Immunology: Innate Immunity N Engl J Med 2000; 343: 338-344
11 Lehrer R, Ganz T, Selsted M. Defensins: endogenous antibiotic peptides of animal cells.Cell 1991, 64:229-230
12 Zanetti M, Gennaro R, Romeo D. Cathelicidins: a novel protein family with a common proregion and a variable C-terminal antimicrobial domain.FEBS Lett 1995, 374:1-5
13 Oppenheim FG, Xu T, McMillian FM, Levitz SM, Diamond RD, Offner GD, Troxler RF. Histatins, a novel family of histidine-rich proteins in human parotid secretion. Isolation, characterization, primary structure, and fungistatic effects on Candida albicans. J Biol Chem 1988, 263:7472-7477
14 Goldman, M.J.. Human beta-defensin-1 is a salt-sensitive antibiotic that is inactivated in cystic fibrosis. Cell. 1997;88:553-560
15 Laible, N.J., and Germaine, G.R. Bactericidal activity of human lysozyme, muramidase-inactive lysozyme, and cationic polypeptides against Streptococcus sanguis and Streptococcus faecalis: inhibition by chitin oligosaccharides. Infect. Immun. 1985; 48:720-728
16 Van der Spek JC, Offner GD, Troxler RF, Oppenheim FG. Molecular cloning of human submandibular histatins.Arch Oral Biol 1990; 35:137-143
17 Mathan M, Hughes J, Whitehead R. The morphogenesis of the human Paneth cell: an immunocytochemical ultrastructural study. Histochemistry 1987; 87: 91-96
18 Ganz T. Paneth cells--guardians of the gut cell. Nature Immunol 2000; 1:99-100
19 Ikeda, K., Sannoh, T., Kawasaki, N., Kawasaki, T., and Yamashina, I. Serum lectin with known structure activates complement through the classical pathway. J. Biol. Chem. 1987;262:7451-7454
20 Sastry, K., and Ezekowitz, R.A.. Collectins: pattern recognition molecules involved in the first line of host defense. Curr. Opin. Immunol. 1993;5:59-63
21 Sumiya M, Super M, Tabona P, y col. Molecular basis of opsonic defect in immunodeficient children. Lancet 1991;337:1569-70
22 Epstein J, Eichbaum Q, Sheriff S, Ezekowitz RA.. The collectins in innate immuniti. Curr Opin Immunol 1996;8:29-35
23 Thomas CA, Li Y, Kodama T, Suzuki H, Silverstein SC, El Khoury J. Protection from lethal gram-positive infection by macrophage scavenger receptor-dependent phagocytosis. J Exp Med 2000;191:147-156
24 Gay NJ, Keith FJ. Drosophila Toll and IL-1 receptor. Nature 1991; 351;355-6
25 Hashimoto C,Hudson KL,Anderson KV. The Toll gene of Drosophila, required for dorsal-ventral embrionic polarity,appears to encode a transmembrane p.
|

