|
El asma según la definición aportada por un grupo de expertos del Instituto de la Salud de EEUU en 1997 es "un desorden inflamatorio crónico de las vías aéreas en el que intervienen y desempeñan un papel importante muchas células y elementos celulares; en particular, mastocitos, eosinófilos, linfocitos T, macrófagos, neutrófilos, y células epiteliales. En individuos susceptibles, esta inflamación provoca episodios recurrentes de disnea, ahogo, distensión torácica, y tos, particularmente por la noche o por la mañana temprano. Estos episodios normalmente están asociados con obstrucción del flujo aéreo de forma prolongada pero inconstante y que es a menudo reversible espontáneamente o con tratamiento. La inflamación también causa un aumento de la hiperrespuesta bronquial asociada a una variedad de estímulos.1
Del examen postmortem de los pulmones de los pacientes surge en forma evidente la existencia de un típico infiltrado inflamatorio compuesto por neutrófilos, eosinófilos, células mastocíticas con degranulación, espesamiento de la membrana basal, pérdida de la integridad del epitelio y finalmente oclusión de la luz bronquial por mucus.
Este infiltrado inflamatorio está usualmente acompañado por descamación de la capa epitelial bronquial, hiperplasia e hipertrofia de los músculos lisos de los bronquios e hiperplasia de las células "goblet" o en copa, cuya función es la de secretar mucus, fluido viscoso compuesto principalmente por mucina, que
corresponde a un conjunto de proteínas glicosiladas.
Este mucus, que en los períodos de reposo es acumulado en gránulos en las células "copa"2, cuando se secreta a la luz bronquial lo hace tal como se produce al oprimir la válvula de un envase de espuma de afeitar, aumentando su vo-lumen hasta 500 veces en 20 milisegundos.
Una explicación propuesta para este fenómeno es que la mucina está recubierta dentro de los gránulos intracelulares por una abundante proporción de cargas negativas (polianónicas) que dentro de la célula están "enmascaradas" o "neutralizadas" por los iones cálcicos. Durante la exocitosis, el poro membranoso se abre a la luz extracelular permitiendo al calcio salir rápidamente. Esto resulta en una fase extremadamente rápida basada en la repulsión de las cargas polianónicas y a la hidratación lo que lleva a la expansión del gel de mucina que forma luego el tapón mucoso.
Aunque desde hace mucho tiempo se le otorgó una importancia fundamental en el asma a la respuesta mediada por anticuerpos IgE en los
pulmones, recién en la última década se lograron avances reales en el conocimiento del intrincado mecanismo fisiopatológico en la iniciación y mantenimiento del desorden alérgico e inmunológico, así como la inflamación y su papel en la cronificación de la enfermedad.
El comienzo de la síntesis de IgE parte del encuentro del alergeno con las células dendríticas y precisamente en este sostenimiento de la respuesta se basa la severidad del cuadro asmático.
Ahora estos estudios llevados a cabo en muestras de mucosa bronquial de pacientes con "asma leve" muestran que la existencia de la inflamación puede evidenciarse también en estos pacientes tanto en las vías aéreas periféricas como en las superiores.3-4
El proceso inflamatorio de las estructuras bronquiales resulta, según las investigaciones en el campo inmunológico5, de una inapropiada respuesta a antígenos ambientales en individuos genéticamente susceptibles, respuesta que está orquestada por un subgrupo celular de los linfocitos T helper CD4+ denominadas células T helper 2 (Th2).
También una evidencia de la respuesta inflamatoria en el asma es la presencia en el líquido de lavado broncoalveolar de citoquinas y quimioquinas quimiotácticas producidas por las células inflamatorias de las vías aéreas que tienen numerosos efectos sobre las células residentes en el árbol respiratorio en los que colaboran una variedad de redes autocrinas, paracrinas y endocrinas en la producción y mantenimiento de los fenómenos asmáticos6. Las citoquinas involucradas alcanzan a un número considerable de sustancias que tienen origen en muy diversos elementos celulares y como blanco final otros tantos destinos, a efecto solo de simplificar el cuadro podrían clasificarse como :
1. Factores de crecimiento y estimuladores de colonias
2. Interferones a, b y g
3. Interleuquinas 1 a 18
Asimismo las funciones de estos efectores abarcan diversos destinos entre los que se pueden destacar:
1. Producción de células (fibroblastos).
2. Maduración celular.
3. Proliferación, diferenciación y activación celulares.
4. Producción de citoquinas e interferones.
5. Producción y crecimiento de células B.
6. Inhibición de la replicación viral.
7. Proliferación de células progenitoras.
8. Migración de neutrófilos.
9. Producción o Inhibición de moléculas del MHC clase II.
10. Proliferación, quimioatracción, adhesión, activación, aumento del tiempo de sobrevida y degranulación de los eosinófilos.
11. Remodelación de las vías aéreas.
Las citoquinas juegan un papel fundamental en el desarrollo del asma por la regulación de la expansión de las células Th2 ya citadas, y además por la mediación en muchas de las funciones efectoras de estas células Th2 que influyen en los eventos de una respuesta asmática.
Está definido hoy que de los dos grupos celulares que conforman a las células CD4+, las Th1 y Th2 ambas segregan perfiles distintos y
definidos de citoquinas y por ello coordinan diferentes clases de respuestas inmunitarias.
Así las Th1 segregan IL-2, IFNg e IFNb mientras que las células Th2 producen IL-4, IL-5, IL-6, IL-10 e IL-13 7.
Al respecto es aceptado que las células Th1 están involucradas en la generación de la respuesta de hipersensibilidad retardada, mientras que las Th2 están dirigidas a montar fuertes respuestas de tipo humoral mediante la facilitación de la proliferación de células B8.
En particular este tipo de respuesta humoral con células B tan beneficioso cuando se trata de la eliminación de parásitos puede ser peligroso y dañino cuando se dirige hacia elementos antigénicos del medio ambiente que serían inocuos como ocurre en la patogénesis de las enfermedades alérgicas como el asma.
En este campo las citoquinas IL-4, IL-5 e IL-13 promovidas por las células Th2 controlan a los componentes mayores que caracterizan a las respuestas inflamatorias asmáticas incluyendo a la activación de la producción de Ig-E , la producción de mucus, y el reclutamiento y la activación de los eosinófilos. Es quizás por este motivo que la población de células Th2 se encuentra notablemente aumentada en los sujetos asmáticos y su presencia íntimamente
correlacionada con la hiperrespuesta de las vías aéreas a los antígenos.
Las citoquinas IL-12 e IL-4 desde las células T helper "naive" dirigen respectivamente la diferenciación de las células Th1 y Th2, a punto tal que animales de laboratorio carentes de estas citoquinas son incapaces de montar las respectivas respuestas, además las dos citoquinas no solo promueven la diferenciación de los respectivos grupos celulares, sino que a su vez bloquean la generación del tipo opuesto.
Estas interleuquinas IL-12 e IL-4 para actuar activan la cascada de señalamiento JAK-STAT 9.
En esta vía de señalamiento, la unión de la citoquina a su receptor promueve la activación de miembros de la familia de los receptores de las quinasas JAK.
Estas quinasas activan subsecuentemente vía fosforilación de la tirosina, factores preexistentes citoplasmáticos llamados STAT (transductores de señal y activadores de la transcripción) .
Luego la fosforilación de la tirosina permite a las proteínas STAT dimerizarse y traslocarse hacia el núcleo donde median los cambios de la expresión génica uniéndose a elementos específicos del ADN.
El éxito que puede llegar a tener la reciente inclusión de la terapia anti Ig-E con anticuerpos monoclonales recombinantes humanizados rhuMAb-E25 en el tratamiento de los casos de asma atópico subraya la importancia que tiene este mecanismo de activación 10.
De la excelente revisión sobre el tema efectuada por Busse y Lemanske en N Engl J Med 5 condensamos algunas conclusiones sobre este tema.
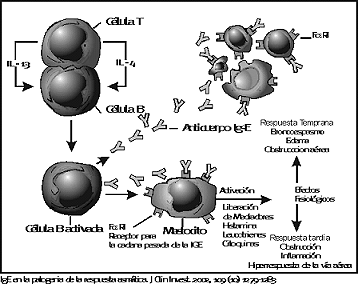
Los anticuerpos IgE liberados por las células B, circulan brevemente en la corriente sanguínea para unirse casi de inmediato con los receptores de alta afinidad FceRI (receptores para la cadena pesada épsilon de la IgE) que se encuentran en la superficie de los mastocitos en los tejidos o en los basófilos de la sangre periférica.
Los mastocitos que derivan desde la médula ósea, entran en la circulación como células mononucleares CD34+, que además son positivas para el factor Stem Cell y para el FceRI, viajan a la mucosa y la submucosa de las vías aéreas. La unión de los mastocitos con la IgE inducido por el alergeno posibilita la liberación de mediadores tales como la histamina e inicia la síntesis de metabolitos del ácido araquidónico, además de soportar estructuras proteicas con fines tan diversos como la "remodelación" de las vías aéreas o ejercer efectos como la proli-feración de células, la adhesión y la motilidad celular y la morfogénesis tisular.
Los mastocitos producen varias citoquinas como IL-1, IL-2, IL-3, IL-4, IL-5, factor estimulador de colonias macrófagogranulocíticas, interferón-g y factor de necrosis tumoral-a; todos estos hechos apoyan la idea de que posiblemente los mastocitos contribuyen tanto en la producción de inflamación alérgica aguda como crónica.
En los pacientes con asma la inhalación de alergenos precipita la producción de la obstrucción de la vía aérea que se inicia por la liberación de histamina y leucotrienes por los mastocitos, los que provocan la contracción de los músculos lisos de los bronquios. Esta es la fase temprana que se resuelve dentro de la hora, pero cuatro a seis horas más tarde aparece la fase tardía de reacción al antígeno la que es debida a la
liberación de citoquinas y quimioquinas por las células inflamatorias residentes en el árbol aéreo (mastocitos, macrófagos y células epiteliales) y por las células reclutadas desde la circulación sanguínea (linfocitos y eosinófilos), fase en la que se desarrolla la obstrucción del flujo aéreo en la vía respiratoria.
La maduración y evolución de los eosinófilos originados en la médula ósea están regidas por la IL-3, IL-5, factor estimulador de colonias macrófagogranulocitarias, siendo la IL-5 la que induce la diferenciación terminal de los esosinófilos inmaduros.
Las células eosinófilas maduras contienen una serie de gránulos densos intracelulares cargados de proteínas proinflamatorias tales como:
Neurotoxina derivada de los eosinófilos
Peroxidasa
Proteínas catiónicas
Cistinil Leucotriene C4.
Estas sustancias y otras proteínas pueden dañar directamente a las vías aéreas, aumentar la repuesta bronquial y provocar degranulación en los basófilos y los mastocitos, todo lo cual aumenta la severidad del asma, contrae a los músculos lisos, aumenta la permeabilidad vascular y termina reclutando más eosinófilos hacia la vías aéreas, todo acompañado por la acción de la IL-5 que estimula la llegada de más eosinófilos a la circulación, aunque la IL-5 sola no es capaz de desencadenar un ataque de asma en los seres humanos.
Es interesante destacar que para participar en el proceso alérgico el eosinófilo debe migrar desde la circulación hasta vía aérea, proceso que se desarrolla por la mediación de la P-selectina la que provoca el llamado "rolling" o rodamiento de la célula sobre el endotelio de los capilares bronquiales, en este proceso participan también las integrinas b 1 y a 4 b 1 , esta última denominada también como antígeno VLA4 (very late antigen 4), estas integrinas se unen a las moléculas de adhesión de las células endoteliales (VCAM-1) y a las moléculas de adhesión intercelular (ICAM-1).
El eosinófilo finalmente penetra en la mucosa de la vía aérea luego de este "rolling" por acción de varias quimioquinas y citoquinas, para finalmente descargar los mediadores inflamatorios de sus gránulos. Además este eosinófilo activado puede a su vez generar factor estimulador de colonia macrofágica-fagocítica (GM-CSF) que prolonga su propia sobrevida .
Siguiendo con la complicada vía de activación de la inflamación de la vía aérea en el asma, las quimioquinas RANTES, la proteína 1, y las eotaxinas son fundamentales en la llegada de eosinófilos hasta la vía aérea, recordemos en este paso que el tipo de infiltrado inflamatorio que caracteriza a una enfermedad específica está controlado por el subgrupo de quimioquinas que expresa el tejido enfermo11, al respecto también se conoce que el principal estímulo para la producción de estas quimioquinas son la presencia de citoquinas proinflamatorias tempranas como la IL-1 el TNF-a los productos bacterianos (lipopolisacáridos) y la infección viral; además también pueden sinergizar la producción de quimioquinas el IF-g y la IL-4 producidas precisamente en el asma por los linfocitos Th1 y Th212 respectivamente.
En el asma, la rinitis y la dermatitis atópica existe una acumulación selectiva de eosinófilos y mastocitos en la que los mediadores derivados de ellos (quimioquinas) participan en la patogénesis de estas enfermedades alérgicas 13-14.
Asimismo en los exámenes histológicos de tomas biopsias de pacientes asmáticos leves y graves han demostrado que después del contacto con el alergeno, aparecen linfocitos con marcadores de activación en su superficie, y tanto los linfocitos helper Th1 y Th2 como los linfo-linfo-citos CD8+, Tc1 y Tc2 normalmente se inhiben recíprocamente en su acción liberadora de citoquinas por lo que es dable pensar que la inflamación alérgica asmática exista un mecanismo mediado por los linfocitos Th2 15.
Sin embargo los estudios sobre el IF-g que es producido por los Th116 demuestran que está aumentado en el asma por lo que esta idea de que la inflamación podría ser debida a una primacía de los Th2 parece no coincidir con los hallazgos anteriores, esto último reforzado por la presencia de IF-g 17 que contribuye a la activación de los eosinófilos y por lo tanto también aumentaría la inflamación.
Otras derivaciones de este estudio del balance entre las células Th1 y Th2 llega hasta la hipótesis de que éste surge ya en la vida intrauterina en la cual el sistema inmunitario del feto estaría na-turalmente desviado, de manera tal que en el recién nacido el equilibrio está sesgado hacia las células Th2 y necesitaría estímulos oportunos y apropiados del medio ambiente para crear una respuesta inmune equilibrada en el resto de su vida, de no ocurrir estas acciones oportunamente, se desarrollarían las enfermedades atópicas alérgicas y el asma18-19 .
Hasta aquí se ha pretendido revisar someramente los datos hasta ahora conocidos sobre los meca-nismos inflamatorios e inmunológicos en el asma, pero esta inflamación crónica que está presente no solo en el asma sino que aparece también en la fibrosis quística (FQ), la enfemedad pulmonar obstructiva crónica (EPOC) y la displasia broncopulmonar (DBP) provoca cambios estructurales en las vías aéreas y en el parénquima pulmonar que afectan la funcionalidad de estos tejidos, estos cambios se han denominado remodelamiento o ("remodelling").
Estas transformaciones inflamatorias y de remodelamiento no deben ser consideradas como "fijas", sino más bien como un estado de cambio dinámico de las células y del turnover de la matriz proteica de los tejidos de las vías aéreas, cambios que ocurren tanto en los tejidos de individuos enfermos como en los sanos.
En este sentido el contexto en el que ocurre el desarrollo de los pulmones desde la vida embrionaria hasta la adultez están influidos enormemente por una gran cantidad de factores de crecimiento, factores que parecen también están involucrados en la inflamación y el remodelamiento en los estados patológicos y que pueden ser los mismos que intervienen en aquel.
Así en el epitelio del asmático se aprecia en el líquido del lavado broncoalveolar una descamación acentuada20 , a punto tal que en biopsias de pacientes de adultos con asma leve esta pérdida de epitelio resulta prominente.
Un extenso engrosamiento de la membrana basal ha sido descripto en el asma 21 y puede ser visto en estadios primarios de la afección.
La capa interna de la vía aérea, (tejido comprendido entre la membrana basal y el músculo liso que contiene una red densa microvascular y una infiltración de tejido fibroso), también está engrosada comúnmente en el asma y en las afecciones inflamatorias del pulmón, aún en casos leves.
El grosor de la capa de músculo liso que normalmente ocupa el 5 al 10 % del espesor de la pared bronquial de los bronquios pequeños y solamente el 1 al 2 % de la pared de los bronquios gruesos, se muestran aumentados en los casos de asma fatal y la proporción del aumento es mayor
en las vías aéreas periféricas 23 que en las centrales.
El cartílago que es un componente principal de la pared externa de los bronquios, muestra en pacientes con asma y EPOC una degeneración y una fibrosis pericondrial24 mucho mayor que en los sujetos control.
En cuanto al parénquima pulmonar existe una interdependencia funcional muy fuerte con las vías aéreas. En los pacientes adultos asmáticos se ha demostrado la presencia de una inflamación alveolar considerable25 que evidentemente influye en las anormalidades funcionales de estos pacientes.
Todos estos hechos sugieren que una terapéutica acertada en el futuro deberá estar dirigida a prevenir sobre todo en los primeros años de vida los cambios estructurales, sobre todo en individuos predispuestos, que luego en la adultez parecen ser irreversibles, además de tratar de suprimir como lo están intentando actualmente distintas terapias la supresión de la inflamación y en particular aquellos mecanismos Ig-E dependientes que están íntimamente ligados al desencadenamiento, la persistencia y la severidad de la enfermedad.
BIBLIOGRAFÍA
1.The Expert Panel Report II. Guidelines for the Diagnosis and Management of Asthma.
National Asthma Education and Prevention Program. National Heart, Lung and Blood Institute, National Institutes of Health; 1997.
2.Verdugo P. Goblet cells secretion and mucogenesis. 1990. Ann Rev Physiol 52 : 157.
3. Haley KJ, Sunday ME, Wiggs BR, y col. Inflammatory cell distribution within and along asthmatic airways. Am J Respir Crit Care Med. 1998;158 : 565-572.
4.Tiddens H, Silverman M, and Bush A. Am. J. Respir. Crit. Care Med., 2000, 162 (2) S7-S10.
5.Wills-Karp, M. Immunologic basis of antigen-induced airway hyperresponsiveness. Annu. Rev. Immunol. 1999, 17:255-281.
6.William W. Busse, and Robert F. Lemanske, Asthma. N Engl J Med 2001; 344:350-362.
7.Seder, R., and Paul, W. 1994. Acquisition of lymphokine-producing phenotype by CD4+ T cells. Annu. Rev. Immunol. 12:635-673.
8.Sad S, Marcotte R, Mosmann TR. Cytokine-induced differentiation of precursor mouse CD8+ T cells into cytotoxic CD8+ T cells secreting Th1 or Th2 cytokines. Immunity 1995;2:271-279.
9.Pernis A B, Rothman P B.. JAK-STAT signaling in asthma. J Clin Invest. 2002; 109, (10), 1279-1283.
10. Milgrom H, Fick RB Jr, Su JQ, y col. Treatment of allergic asthma with monoclonal anti-IgE antibody. N Engl J Med 1999;341:1966-1973.
11.Chollet-Martin S, Montravers P, Gibert C, y col. High levels of interleukin-8 in the blood and alveolar spaces of patients with pneumonia and adult respiratory distress syndrome. Infect Immun 1993;61:4553-4559.
12.Garcia-Zepeda EA, Rothenberg ME, Ownbey RT, Celestin J, Leder P, Luster AD. Human eotaxin is a specific chemoattractant for eosinophil cells and provides a new mechanism to explain tissue eosinophilia. Nat Med 1996;4:449-456.
13.Bousquet J, Chanez P, Lacoste JY, y col. Eosinophilic inflammation in asthma. N Engl J Med 1990;323:1033-1039.
14. Humbert M, Ying S, Corrigan C, y col. Bronchial mucosal expression of the genes encoding chemokines RANTES and MCP-3 in symptomatic atopic and nonatopic asthmatics: relationship to the eosinophil-active cytokines interleukin (IL)-5, granulocyte macrophage -colony-stimulating factor, and IL-3. Am J Respir Cell Mol Biol 1997;16:1-8.
15. Sad S, Marcotte R, Mosmann TR. Cytokine-induced differentiation of precursor mouse CD8+ T cells into cytotoxic CD8+ T cells secreting Th1 or Th2 cytokines. Immunity 1995;2:271-279.
16. Holtzman MJ, Sampath D, Castro M, Look DC, Jayaraman S. The one-two of T helper cells: does interferon-gamma knock out the Th2 hypothesis for asthma? Am J Respir Cell Mol Biol 1996;14:316-318.
17. Randolph DA, Carruthers CJL, Szabo SJ, Murphy KM, Chaplin DD. Modulation of airway inflammation by passive transfer of allergen-specific Th1 and Th2 cells in a mouse model of asthma. J Immunol 1999;162:2375-2383.
18. Matricardi PM, Rosmini F, Ferrigno L, et al. Cross sectional retrospective study of prevalence of atopy among Italian military students with antibodies against hepatitis A virus. BMJ 1997;314:999-1003.
19. Shirakawa T, Enomoto T, Shimazu S, Hopkin JM. The inverse association between tuberculin responses and atopic disorder. Science 1997;275:77-79.
20. Ollerenshaw, S. L., and A. J. Woolcock. Characteristics of the inflammation in biopsies from large airways of subjects with asthma and subjects with chronic airflow limitation. Am. Rev. Respir. Dis. 1992; 145: 922-927.
21. Cutz, E., H. Levinson, and D. M. Cooper. Ultrastructure of airways in children with asthma. Histopathology 1978; 2: 407-421.
22. Carroll, N. G., C. Cooke, and A. L. James. Bronchial blood vessel dimensions in asthma. Am. J. Respir. Crit. Care Med. 1997; 155: 689-695.
23.Kuwano, K., C. H. Bosken, P. D. Paré, T. R. Bai, B. R. Wiggs, and J. C. Hogg. Small airways dimensions in asthma and chronic obstructive pulmonary disease. Am. Rev. Respir. Dis. 1993; 148: 1220-1225.
24.Haraguchi, M., S. Shimura, and K. Shirato. Morphometric analysis of bronchial cartilage in chronic obstructive pulmonary disease and bronchial asthma. Am. J. Respir. Crit. Care Med. 1999; 159: 1005-1013.
25.Kraft, M., R. Djukanovic, S. Wilson, S. T. Holgate, and R. J. Martin.. Alveolar tissue inflammation in asthma. Am. J. Respir. Crit. Care Med. 1996; 154: 1505-1510.
|

