|
Todas las células de la médula ósea incluyendo a las líneas de las series eritroide, los monocitos -granulocitos, los linfocitos y los megacariocitos derivan de una población de células presentes en pequeño número en ese territorio (menos del 1%) que han sido denominadas células "stem".
Estas células se parecen morfológicamente a elementos mononucleares con apariencia de "linfo-citos transicionales" o blastos, no existiendo una rutina para su reconocimiento morfológico con los procedimientos habituales de tinción. Son capaces de una diferenciación y proliferación extensa y dependiendo de su estadio de diferenciación, tienen una capacidad variable de auto renovación1.
Las células "stem" forman un compartimiento celular heterogéneo con una amplia capacidad potencial de diferenciación y proliferación.
Aunque las características de las células "stem" deben ser vistas probablemente como formando un continuo desde las formas más primitivas y menos diferenciadas hasta las relativamente maduras, es útil desde un punto de vista práctico dividirlas en compartimentos basados en la capacidad de renovación y por su vía de diferenciación.
Así la progenie que nos interesa en esta pequeña actualización, es la de la línea linfocitaria, sus rasgos de conformación y distintas interacciones, que cuando fallan provocan las distintas inmuno-deficiencias como se puede ver en el Esquema 12.
Los linfocitos, cuya extraordinaria importancia en la inmunología fuera descubierta por James B. Murphy en 1914 3 4, con comunicaciones que inexplicablemente permanecieron ignoradas por el mundo médico hasta la mitad del siglo pasado, son así una de las cinco clases de leucocitos que circulan en la sangre, y aunque morfológicamente los linfocitos maduros se parecen todos entre sí, tienen en cambio características funcionales extraordinariamente diversas, cuyo descubrimiento y descripción modificaron todo el conocimiento sobre los mecanismos inmunológicos en los últimos 40 años 4.
Los linfocitos representan alrededor de un tercio del total de los leucocitos de la sangre periférica, y de este segmento dos tercios corresponden a las células T y un tercio lo componen las células B, aunque esta diferenciación tampoco puede ser efectuada morfológicamente.
Un 10% de los linfocitos son células más grandes caracterizadas por un abundante citoplasma con unos gránulos rojizos, estos son las células "Natural Killer", o "asesinos naturales" (NK), denominados así por su capacidad de destruir a las células infectadas con virus y a las células CMH o HLA incompatibles.
Las dos clases más abundantes son los linfocitos T y los linfocitos B (o burso dependientes, por haber sido identificados en la Bursa de Fabricius en las aves6) siendo que estos últimos nacen en los seres humanos a partir de sus progenitoras en la médula ósea y también maduran allí, en cambio
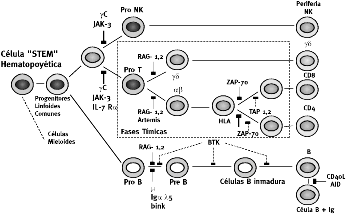
Esquema 1. La diferenciación de las células "Stem" en la médula ósea da origen a todas las distintas progenies hematopoyéticas, en particular en lo referente a las células linfoideas da origen a las tres líneas principales NK, T y B. En este esquema tomado de Alain Fischer. Lancet 2001; 357:1866, se aprecian algunos de los productos de distintos genes que intervienen en la rediferenciación de cada predecesor, cuyas fallas o ausencias dan origen a las distintas afecciones por inmunodeficiencia y aún participan en el desarrollo de malignidades de los tejidos linfoideos. P. ej. las endonucleasas RAG-1,2 provocan inestabilidad genómica y controlan las complicaciones en el gen p53 en las leucemias linfoblásticas y la ausencia del gen RAG 2 provoca el desarrollo de complicaciones leptomeníngeas en las proliferaciones malignas linfoblásticas.
La tirosina quinasa de Bruton (BTK), es el producto de un gen que en la agammaglobulinemia ligada al cromosoma X muestra su importancia en la función linfocitaria.
Investigadores del Instituto Curie en Francia han descripto recientemente el papel esencial de la proteína ZAP-70 en las comunicaciones entre las células T, efecto claramente observado en la inmunodeficiencia combinada severa, donde su ausencia se mani-fiesta por infecciones pulmonares severas por gérmenes oportunistas ( Pneumocystis carinii), diarrea crónica, deficiencia en el crecimineto y candidiasis persistente.
los linfocitos T emergen de la médula ósea y deben pasar por el timo para completar su maduración, órgano del que toman su denominación T o tímicos.
Cada célula B o T madura está específicamente dotada para reaccionar con un antígeno único, lo que significa que cada una es capaz de reconocer y unirse a sólo una molécula con una estructura particular.
Esta especificidad característica reside en la propiedad del receptor antigénico que se deno-mina RCB (receptor de célula B ) en el caso de los linfocitos B y RCT (receptor de célula T ) en el caso de los linfocitos T.
Ambos receptores comparten varias propiedades:
a) Son proteínas integradas a la membrana celular.
b) Están presentes en número de miles de copias idénticas en cada célula, expuestas en la superficie de la membrana.
c) Se producen antes de que la célula se encuentre con el antígeno.
d) Están codificados por genes armados por la recombinación de segmentos de ADN.
e) Tienen un solo sitio de unión.
f) Este sitio se une a un fragmento de antígeno que es denominado determinante antigénico o epítope.
g) La unión es similar a la que se efectúa entre una enzima y su substrato y depende de la complementariedad de la superficie del receptor y la superficie del epítope.
h) La unión se efectúa por fuerzas no covalentes similar a las que unen a las enzimas con los subs-tratos.
i) La unión exitosa del receptor antigénico con el epítope es acompañada por "señales" adicionales que provocan como veremos luego la formación de la sinapsis inmunológica.
j) Estimulación de la célula para salir del estadio G0 y volver a entrar en el ciclo celular.
k) El resultado de mitosis repetidas en las células estimuladas lleva al desarrollo de un clon celular que transporta el mismo receptor antigénico e idéntica especificidad.
Tres aspectos fundamentales diferencian a los receptores RCB de los RCT, ellos son, su estructura, los genes que los codifican y el tipo de epítope a los cuales se unen.
El procesamiento proteico y la exhibición de los péptidos resultantes de su degradación por medio de las moléculas del complejo mayor de histocompatibilidad CMH tipo I se efectúa constantemente y en todas las células del organismo, por lo que existe una gran cantidad de material que entra en contacto con las otras células y esto es lo que sucede con el material propio constituyente del organismo.
Por otro lado el procesamiento de las proteínas exógenas y su exhibición al exterior, es decir en la superficie de las membranas celulares sólo tiene lugar en las células B, los macrófagos y las células dendríticas, las que lo hacen mediante las moléculas del CMH tipo II.
Aunque en general se acepta que esta demarcación en el tratamiento del material "propio" y el "exógeno" se efectúa de esta manera, en la realidad esta separación no es tan absoluta, existiendo demostraciones de que existen moléculas de CMH clase I transportando péptidos de origen bacteriano.
La consecuencia del procesamiento proteico continuo por las células es que las superficies celulares están constantemente recubiertas por péptidos transportados por moléculas del CMH en una cantidad que ronda entre 100.000 a 300.000 moléculas por célula, esto significa que cada célula normal que no esté infectada exhibirá cientos o miles de péptidos propios en su superficie.
Algunos de estos péptidos están presentes en miles de copias iguales mientras que otros sólo son mostrados en forma mucho más discreta, pero la mayoría de los péptidos tiene por lo menos unas 100 copias en la superficie de una célula. Siguiendo a la metáfora de Klein y Sato7, la resultante es un "gran bazar" de moléculas expuestas con un grupo de "vendedores", las moléculas HLA y potenciales "clientes" las células T.
Las moléculas del CMH, citando a Robert S. Schwartz8, actúan como un vehículo de recolección de residuos, llevando a éstos continuamente desde el interior de la célula al exterior. El resultado es que la célula T peripatética encuentra una exhibición de péptidos propios exhibidos sobre la superficie de las células presentadoras de antígenos y en la mayoría de los casos las células T ignoran a estos péptidos y permanecen quiescentes.
Las Células T, la selección "positiva" y la selección "negativa".
Cuando los linfocitos T están en sus estadios iniciales se los llama células T "naive" y para pro-seguir con su evolución deben determinar si está presente un antígeno y si éste significa una amenaza para el organismo.
Aunque requieren múltiples señales para su activación, esta información es provista principalmente por las células dendríticas en los órganos linfoideos secundarios, que se encargan de recolectar y atrapar todos los antígenos que penetren en el organismo. También otras señales son las denominadas coestimulatorias y comprenden a los productos bacterianos como las endotoxinas, las citoquinas de las células presentadoras deantígenos o CPA y las moléculas de adhesión9.
Las células T precursoras migran desde la médula ósea hacia la zona corticomedular del timo, donde si se encuentran con antígenos apropiados comienzan a diferenciarse rearre-glando los genes de las regiones variables de las dos cadenas que conforman el receptor, lo que conduce a la proliferación y la salida de la célula hacia la región medular de la glándula tímica.
Sin embargo casi el 98 por ciento de los linfocitos inmaduros que penetran en el timo sufren la apoptosis. Este hecho tan singular de la apoptosis casi generalizada depende del grado de afinidad que tengan sus receptores para con los complejos péptidos-CMH, si la afinidad es alta la célula muere, si no existe afinidad la célula también muere, para que ella sobreviva es necesaria una afinidad en su "justo medio". De aquí pues, que la sobrevida del linfocito es denominada "selección positiva" por la afinidad exacta, mientras que los extremos de alta o baja afinidad que provocan la apoptosis se denomina "selección negativa".
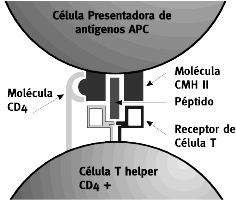
Figura 1. Interacción célula presentadora de antígeno y
linfocito. CD4+
Algunos de los linfocitos con alta afinidad con el antígeno no mueren y se transforman en células memoria exhibiendo en su membrana el marcador CD2, comenzando a viajar entre los ganglios linfáticos, el intestino y la piel en búsqueda del antígeno uniéndose este marcador CD2 con un ligando que se ubica en la superficie de las células dendríticas el LFA3 (antígeno asociado con la función linfocitaria). En este sentido se está investigando la aplicación de terapéutica con anticuerpos monoclonales para inhibir la interacción entre las dos moléculas como tratamiento de la psoriasis10.
Existen dos tipos estructuralmente diferentes de receptores de células T, los receptores con cadenas alfa / beta y los receptores que tienen cadenas gamma / delta.
Los linfocitos T con receptores alfa / beta se unen a un complejo bimolecular exhibido en la superficie de la membrana de otras células que se denominan células presentadoras de antígenos (CPA), el complejo bimolecular está compuesto por un fragmento de un péptido insertado en una molécula del complejo mayor de histocompatibilidad (CMH).
La mayoría de las células T alfa / beta pertenecen a una de las dos subclases, que se distinguen por la presencia en su superficie de una u otra glicoproteína designadas como CD4 o CD8, la pre-sencia de una de estas dos moléculas en la superficie de la membrana del linfocito indica la función y destino de la misma.
Las células CD4+ se unen a epítopes que consisten en un fragmento antigénico insertado en la cavidad de una molécula de CMH de clase II, (figura1) reiterando que solamente expresan este tipo de molécula (CMH II) las células presentadoras de antígenos como las células dendríticas, los fagocitos como los macrófagos , y las células B.
Los linfocitos CD4+ son esenciales para la existencia de ambas vías del sistema inmunitario, la mediada por células y la producción de anticuerpos.
A su vez los linfocitos CD4 se dividen en dos poblaciones mayores los Th1 que segregan interferón-g e interleuquina-2 que activan a los macrófagos y a las células T citotóxicas para matar a los organismos intracelulares; y las células Th2 que segregan interleuquina- 4, 5, 6 y 10 que ayudan a las células B para segregar anticuerpos. El complejo balance entre la secreción de citoquinas de ambos tipos de linfocitos Th puede resultar importante en procesos graves como la desmielinización y la destrucción de islotes pancreáticos y diabetes11.
A su vez las células linfocitarias CD8+ se unen a los epítopes que forman parte de moléculas del CMH clase I, siendo en este caso la mayoría de las células del organismo las que expresan moléculas de Clase I. Las células CD8+ usualmente tienen una función citotóxica, estando provistas de mecanismos para atacar a las células que muestren en su superficie péptidos derivados de las proteínas intracelulares virales que siempre van unidos a moléculas del CMH tipo I.
La muerte de las células infectadas se lleva a cabo por medio de dos mecanismos: 1) por la inserción de perforinas en la membrana de la célula blanco lo que produce poros, a través de los cuales pasan las enzimas (caspasas que inducen la apoptosis) de las células citotóxicas a la célula infectada; 2) el otro mecanismo es el de la unión de la molécula Fas (también denominado CD95) de la célula T citotóxica a los Fas ligandos de las células blanco lo que también induce la apoptosis12. El compromiso de este receptor Fas induce a la apoptosis a la célula Fas +, mecanismo importante porque en el caso en que estos marcadores estén ausentes se desarrollan enfermedades linfoproliferativas severas13.
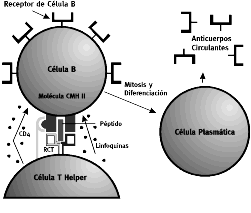
Figura 2. Mecanismo de activación de la proliferación de
las células b y la intervención de las células T helper CD4.
En los estadios tempranos de la evolución, las células T inmaduras expresan ambos tipos de marcadores, este tipo de células inmaduras doblemente positivas CD8+ / CD4+ tienen la potencialidad de reconocer ambas moléculas del CMH tipo I y II.
Las moléculas del CMH I se expresan, como ya se ha citado, en todas las células nucleadas del organismo lo que permite a cualquiera de ellas, en caso de ser infectadas por microorganismos, emitir un aviso a las células T CD8+ y establecer un contacto íntimo con ellas mediante la exposición de la molécula del complejo formado por el CMH de tipo I con el péptido extraño en su superficie y unirse así al receptor de la célula T.
Por otro lado las moléculas de tipo CMH clase II le indican a la célula T helper CD4+ la necesidad de secreción de citoquinas sin necesidad de establecer un contacto muy íntimo como en el caso anterior, lo que se explica porque el sistema inmunitario precisa sólo de algunas pocas células especializadas en el mecanismo de la "presentación de antígenos" tales como las células dendríticas, los macrófagos y las células B.
En la inmunidad mediada por células, las CD4+ se unen al antígeno mostrado por las células presentadoras de antígenos CPA liberando linfoquinas que atraen a otras células en la vecindad. El resultado de esto es la inflamación con acumulación de gran cantidad de macrófagos y moléculas propias de este fenómeno.
Durante los procesos de inmunidad mediada por anticuerpos las células CD4+ helper o ayudantes se unen al antígeno presentado por las células B y el efecto es la formación de un clono de células plasmáticas que segregan anticuerpos específicos para el antígeno mostrado (figura 2).
En general, el papel de las células T CD8 + es el de supervisar a todas las células del organismo, estando preparadas para destruir a cualquiera de ellas que exprese un fragmento de antígeno extraño junto a la molécula CMH de clase II, esta función CD8 es sumamente importante sobre todo en el caso de infecciones virales porque este tipo celular es capaz de destruir a las células infectadas antes de que ellas liberen el virus replicado en su interior (figura 3).
Una pequeña cantidad de las células T presentan en el timo las cadenas gamma y delta para formar sus receptores T. Estas células con receptores T gamma / delta salen muy rápidamente del timo y algunas de ellas aún pueden desarro-llarse fuera de este órgano, muy posiblemente en el intestino.
Las células tímicas T gamma / delta, que no llegan a representar el 5% de los linfocitos de la sangre y 15 % en los epitelios, migran a varias ubicaciones en el organismo, incluyendo al epitelio del tracto gastrointestinal, la piel y la vagina donde se piensa que cumplen funciones de defensa en las mucosas14 y no recirculan entre la sangre y los ganglios como los demás linfocitos.
El encuentro de las células gamma / delta con los antígenos se efectúa en la superficie de los epitelios en las células que los rodean, en vez de hacerlo con las células presentadoras de antígenos en los ganglios como lo hacen las células que tienen cadenas alfa / beta. Sus receptores se unen a antígenos que pueden llegar a ser proteínas intactas, tal como lo hacen los anticuerpos, y hasta moléculas orgánicas muy variables que a menudo contienen átomos de fósforo. Estos antígenos no son presentados al linfocito por una CPA, ni siquiera son tampoco presentadas por las moléculas del CMH I o II.
Otra característica llamativa es la de no poseer marcadores CD8 ni CD4 en su superficie, lo que está de acuerdo con la forma de contactarse con el antígeno ya que no necesitan reconocer a las moléculas CMH I o II.
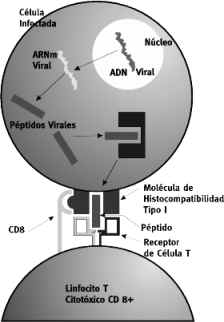
Figura 3. Activación de linfocitos CD8
La función de estas células T gamma / delta, no está claramente dilucidada, pero por su ubicación entre el medio externo y el medio interno es posible que representen la primera línea de defensa contra los agentes invasores, lo que también está en correspondencia con la mayor rapidez que tienen para actuar.
La mayoría de los antígenos con los cuales interactúan los linfocitos gamma / delta corresponden a agentes invasores pero también lo hacen contra células huéspedes que se encuentren atacadas por patógenos. Las cepas de ratones que no producen células T gamma / delta tienen respuestas más lentas en la reparación de las lesiones de piel, además de ser mucho más propensos al cáncer de piel que los ratones normales por lo que se piensa que una de las funciones que tendrían estos linfocitos sería la vigilancia inmunitaria.
Un hecho por demás sorprendente es la demostración de que en el epitelio tímico las células producen y muestran autoantígenos, en este sentido se ha evidenciado que estas células epiteliales tímicas producen por lo menos tres antígenos pertenecientes a los islotes pancreáticos tales son el GADA15(anticuerpo contra la glutamato decarboxilasa), el IA-216(anticuerpo contra tirosin fosfatasa), y el IAA17(anticuerpo anti-insulina), además estas mismas células tímicas producen y muestran en su superficie el autoantígeno del colágeno tipo IV presente en el síndrome de Goodpasture. Una de las finalidades de esta exposición sería la de eliminar mediante apoptosis a todos los linfocitos con alta afinidad con estos antígenos.
Al respecto este despliegue de autoantígenos se sabe que es regulado por un gen18, el AIRE y la experimentación con ratones también demostró que los animales carentes del gen AIRE no desarrollan autoantígenos, más aún, en los seres humanos se desarrollan enfermedades autoinmunes en pacientes carentes de la función de este gen19.
El evento más crítico en la iniciación de la respuesta inmune adaptativa es la activación de los linfocitos T.
Este proceso es mediado por la interacción de los receptores antigénicos de las células T (RCT) con sus ligandos, que son precisamente los complejos formados por los péptidos con las moléculas del complejo mayor de histocompatibilidad (péptido-CMH). Luego de unos pocos segundos de contacto con el complejo péptido-CMH con el RCT provoca el comienzo de una cascada de fosforilación de tirosina que activa vías de señalización múltiples.
Estas señales tempranas pueden ser suficientes para activar la función de algún efector, como la función de una célula T killer.
En contraste, las funciones más complejas, como la proliferación de las células T, requieren el compromiso de los RCT y la señalización durante muchos minutos u horas20.
Sin embargo un contacto sostenido entre los RCT y el CMH enfrenta varias barreras como lo son por ejemplo :
1) El tamaño sumamente pequeño del complejo péptido-CMH.
2) Grandes cantidades de moléculas glicoproteicas como realmente se presentan en forma de marcadores CD43 y CD45 en la membrana del linfocito que conforman una barrera mecánica que dificultan el contacto.
3) El RCT tiene baja afinidad antigénica con el complejo péptido-CMH21.
4) El número de complejos presentados por las células presentadoras de antígenos suele ser bajo22.
5) El movimiento constante que presenta la célula T dificulta el reconocimiento del antígeno23.
Las células T circulantes tienen forma redondeada con una distribución radial de sus receptores24 y microvellosidades en la superficie de la membrana. Estas células no se mueven mucho más allá de lo que las empujan la velocidad del flujo sanguíneo y las moléculas de adhesión en su mayoría integrinas se mantienen en un nivel de baja actividad25.
Una vez activadas las células T por algunas de las señales principales (unión del RCT con el complejo antígeno-CMH) y/o las coestimulatorias (productos bacterianos, endotoxinas, citoquinas de las APC, además de las adhesinas ), existen varios mecanismos que pueden restaurar el estado quiescente, es decir frenar la actividad de las mismas, por ejemplo la presencia de un importante regulador, la molécula CTLA-4 que al aparecer sobre la membrana bloquea la interacción de B7-CD28 (la afinidad de CD80 para con CTLA-4 es 20 veces más ávida que para la CD2826).
Como resultado de la presencia de esta molécula la célula T retorna al estado quiescente y este mecanismo es una de las promesas en el tratamiento de las enfermedades autoinmunes y en la prevención del rechazo de injertos.
Las células presentadoras de antígenos son llamadas también células dendríticas (DC) (aunque son sólo una de las clases de ellas) y actúan ingiriendo el antígeno por fagocitosis, la partícula ingerida por la célula es en estos casos relativamente grande y la burbuja encerrada por una membrana plasmática es denominada fagosoma o vacuola, que luego de su viaje interior en la célula entrega su material a una nueva organela como lo son los lisozomas, fusionándose las membranas de ambas y siendo destruida la bacteria o partícula proteica ingerida en el lisozoma por la acción de enzimas degradatorias.
Otro mecanismo es el de la pinocitosis, donde las partículas y las vesículas que se forman son relativamente pequeñas y por el contrario de lo que sucede con la fagocitosis, que solamente se produce en los neutrófilos y los macrófagos este proceso de pinocitosis ocurre en una gran cantidad de estirpes celulares.
Hoy se acepta que existen por lo menos 2 tipos de células dendríticas, las llamadas DC1 que derivan de los monocitos y presentan los antígenos a los receptores de las células Th1 se-cretando asimismo interleuquina-12 (IL-12) para que a su vez el linfocito estimulado secrete sus propias linfoquinas. Las DC2 que parecen derivar de los linfocitos, serían las que por esti-mulación con la presentación de antígeno a las células Th2 y la producción de algunas otras linfoquinas, dan lugar a la diferenciación de este tipo de célula T helper.
Las células B
Los receptores de las células B se unen a antígenos solubles como lo es por ejemplo el toxoide diftérico producido por acción de la va-cunación antidiftérica.
Las moléculas antigénicas unidas a los receptores son entonces incluidas dentro de las células B por una endocitosis mediada por los mismos receptores.
El antígeno se digiere partiéndose en fragmentos que se despliegan entonces en la superficie de la célula, este fragmento "viaja" dentro de la célula con la molécula del complejo mayor de histocompatibilidad tipo II y es expuesta al final del viaje en la superficie de la membrana junto con esta molécula.
Las células T helper específicas para una estructura, es decir aquellas células que cuentan con los RCT complementarios (figura1) para esta estructura, se unen a las células B y secretan linfoquinas que estimulan a las células B27, de manera tal que ellas reingresen en el ciclo celular a partir del estadio de reposo o G0, y mediante repetidas mitosis se transforman en un clono celular con RCB idénticos, diferenciándose en células plasmáticas y cambiando de esa manera la síntesis de sus RCB originariamente inespecíficos, a una versión de RCB solubles, específicos, los anticuerpos.
La sinapsis inmunológica
Para que se produzca la adhesión tan especializada entre una célula T naive y una célula CPA se necesita una señal innata que lleva a la formación de una primera fase de la sinapsis inmunológica (SI), esta señal es por ejemplo la exposición a las quemoquinas.
Cuando las células T se extravasan hacia los ganglios linfáticos o a una zona de tejido inflamado encuentran un gradiente de quemoquinas, por consiguiente estas células antes de tener contacto con una CPA se encuentran con citoquinas en concentración creciente a medida que se acerca al antígeno.
Para que una célula T sea activada y entre en proliferación se requiere una interacción sostenida entre el receptor RCT con el complejo formado por el CMH y el péptido28. La duración de este contacto está en el orden de las horas mientras que la interacción molecular inhibitoria o activante es del orden de los segundos, este último mínimo lapso es suficiente para activar funciones efectoras como las vías de señalamiento para la acción de las células killer.
Estudios con imágenes29 han demostrado que existe una marcada organización que ayuda en el mantenimiento del contacto y en la especificidad del señalamiento. En este sentido se ha probado que la CPA no es absolutamente requerida para la formación de una SI, pero sí es necesaria para su regulación.
La sinapsis inmunológica está constituida en definitiva por un grupo de receptores T rodeados por un anillo de moléculas de adhesión y su formación es el resultado de un mecanismo activo y dinámico que permite a las células T distinguir entre distintos ligandos antigénicos9.
El estadio final de la formación de una SI, es la estabilización de un grupo de por lo menos 60 complejos de péptidos-CMH por micrómetro cuadrado con sus respectivas contrapartes, los RCT y el mantenimiento de esta unión por lo menos durante una hora lleva a una completa activación de la célula T.
La activación fisiológica de la célula T ha sido dividida en cuatro estadios temporales30:
1) Polarización de la célula T (organización in-trínseca de la membrana plasmática31).
2) Adhesión inicial ( polarización de los linfocitos T por exposición a las quemoquinas y moléculas de adhesión como las LFA-1 e ICAM-1 5).
3) Formación inicial de la Sinapsis inmunoló-gica (unión de RCT/CD3, fosforilación de la tirosina, flujo de iones Ca+ y reconocimiento del complejo CMH-péptido por los RCT) (ocurre entre los 30 segundos y 5 minutos de la activación32 33).
4) Maduración de la SI (señalización sostenida de la célula T desde 15 minutos hasta horas34).
La célula presentadora de antígenos (CPA), la otra mitad de la sinapsis inmunológica.
Como se vio, la SI está conformada en el contexto de los complejos péptido- CMH sobre la célula CPA y los receptores de los linfocitos T, estas células presentadoras de antígenos cumplen un papel activo y fundamental en la generación de los complejos péptido-CMH.
Varios son los tipos celulares que cumplen la función de CPA, por lo menos tres han sido caracterizados en forma fehaciente y ellos son los macrófagos, las células dendríticas y las células B colectivamente llamadas células presentadoras de antígenos profesionales aunque sus varian-tes se extienden bastante más allá (ver tabla 1).
Macrófagos
Son importantes células presentadoras de antígenos, sobre todo cuando el individuo no se ha encontrado previamente con el antígeno (cuando no existen anticuerpos para ese antígeno). Los macrófagos pueden así fagocitar a los microorganismos en ausencia de anticuerpos por detección de la opsonización (recubrimiento del antígeno con partículas C3b). Aunque todos los macrófagos pueden fagocitar partículas extrañas, solo los que expresan moléculas CMH II pueden procesar a este antígeno y activar la ulterior respuesta inmunitaria.
Células Dendríticas
El procesamiento por los macrófagos solos, es bastante ineficiente por lo que existe una vía alternativa que está representada por las células dendríticas35 localizadas en todo el organismo pero muy especialmente en los órganos linfoideos, son células que contienen numerosos fi-lamentos citoplasmáticos que se llaman dendritas. Además poseen un núcleo lobulado con citoplasma claro que contienen gránulos de Birbeck característicos. De los varios tipos de células dendríticas se destacan las células de Langerhans en la epidermis que atrapan y presentan a los antígenos que penetran en la piel.

Células B como presentadoras de antígenos
Las células B pueden ser también células presentadoras de antígenos muy efectivas uniéndose a moléculas enteras de antígeno mediante sus receptores (RCB) presentando luego los antígenos a las células T Helper, por otro lado pueden activar también la endocitosis del antígeno y llevar a cabo su degradación y procesamiento por proteolisis expresando en sus membranas las inmunoglobulinas de membrana o anticuerpos. Para que una célula B responda a un antígeno las mismas deben recibir el estímulo de moléculas coestimulatorias como la CD40 en un complejo de proteína de superficie que contenga a la molécula CD19.
Otras células presentadoras de antígenos
Se incluyen también como claros ejemplos a los eosinófilos, las células vasculares endoteliales y los queratinocitos de la piel, se las incluye dentro del grupo de CPA no profesionales, debido a que ellas no expresan moléculas coestimulatorias. Por ejemplo las células endoteliales pueden tomar a un antígeno y sintetizar luego interleuquina-1 (IL-1) y luego estas mismas células endoteliales expresan el antígeno en su superficie.
La diversidad de los receptores antigénicos
La extraordinaria variabilidad de la especificidad de los anticuerpos llega a la casi increíble cifra de 1015 (mil billones de receptores de distintas estructuras en un individuo) y al mismo tiempo existe una cifra similar de distintos receptores de células T36.
Más extraordinario aún es que este despliegue fastuoso de diversidad se logra con la producción que parte sólo de 400 genes, todo mediante un proceso de corte, pegado y modificación de los genes con intervención de enzimas recombinasas para unir y endonucleasas para escindir que producen como resultado las proteínas de las
regiones variables de las cadenas proteicas de los receptores. En las tablas 2 y 3 se esquematiza en forma muy simplificada la participación de los distintos "cluster" (grupos) de genes que actúan en ellas.
La función de las células B es la de producir anticuerpos protectores con alta afinidad y para cumplir con esta función en forma eficiente la célula trata de aumentar siempre la afinidad de sus propios receptores (moléculas de inmunoglobulinas) mediante la mutación de los genes de la región varia-ble V, lo que sucede siempre en los centros germinales de los ganglios linfáticos con la colaboración indispensable de las células T, por último la acción de un gen maestro, el de la activación inducida por la citidina-deaminasa (AID)37 38 ,el que actúa en los linfocitos en un proceso de hipermutación somática que implica un aumento de la afinidad durante el proceso de maduración linfo-citaria, así como la conmutación que permite el salto entre distintos isotipos de inmunoglobulinas por ej. de IgM a IgG, IgA o IgE.
Este gen AID terminaría la acción de los genes Rag-1 y 239 que actúan en la recombinación de los segmentos VDJ mientras que el AID sería el responsable de la hipermutación somática y la actualización final del isotipo.
Los procesos de recombinación unen a un segmento con otro de otro tipo para formar proteínas lineares para cada cadena de un receptor. Cada linfocito utiliza una combinación diferente de estos genes para dar expresión al código genético del receptor antigénico. El proceso de recombinación sufre generalmente "inexactitudes" en el empalmado de los nucleótidos lo que provoca nuevas variaciones en las uniones de los segmentos VDJ.


Asimismo la enzima deoxi-ribonucleotidil-transferasa puede insertar nuevos nucleótidos en las uniones de los distintos péptidos provocando estos dos procesos un aumento aún mayor en la diversidad de los receptores T y B.
En este sentido el conocimiento de la biología básica una vez más, ampliará la posibilidad de aplicar estos conocimientos en áreas clínicas; como ya lo está haciendo, incluyendo tanto a los linfomas y otros tipos de cáncer, la esclerosis múltiple, las alergias y las enfermedades autoinmunes 40 41 42 43 44 45 46.
1Quesenberry P, Levitt L. Hematopoyetic stem cells. N Engl J Med. 1979 ;301:755, 819,868
2 Ficher A. Primary immunodeficiency diseases: an experimental model for molecular medicine. Lancet 2001; 357: 1863-69
3 Murphy J B. J Exp Med 1914; 19:181-186
4 Silverstein AM. Historical insight: The lymphocyte in immunology: from James B Murphy to James L. Gowans. Nature Immunology 2001; 2: 569-571
5 Gowans JL, Knight EJ. The route of re-circulation of lymphocytes in the rat. Proc R Soc Lond B Biol Sci 1964;159:257-282
6 Cooper, M.D.,Raymond, D.A., Peterson,R.D. South, M.A.Good,R.A. The functions of the thymus system and the bursa system in the chicken. J. of Exp. Med., 1966; 123: (1); 75-102
7 Klein J, Sato A. Advances in Immunology: The HLA System (First of Two Parts). N Engl J Med 2000;343 (10 ); 702-709
8 Schwartz RS. Diversity of the Immune Repertoire and Immunoregulation. N Engl J Med. 2003; 348:1017-1026
9 Bretscher PA. A two-step, two-signal model for the primary activation of precursor helper T cells. Proc Natl Acad Sci U S A 1999; 96:185-190.[
10 Ellis CN, Krueger GG. Treatment of chronic plaque psoriasis by selective targeting of memory effector T lymphocytes. N Engl J Med 2001;345:248-255
11 Pakala SV, Kurrer MO, Katz JD. T helper 2 (Th2) T cells induce acute pancreatitis and diabetes in immune-compromised nonobese diabetic (NOD) mice. J Exp Med 1997;186:299-306
12 Podack ER. Functional significance of two cytolytic pathways of cytotoxic T lymphocytes. J Leukoc Biol 1995;57:548-552
13 Rieux-Laucat F, Le Deist F, Hivroz C. Mutations in Fas associated with human lymphoproliferative syndrome and autoimmunity. Science 1995; 268:1347-1349.
14 Goodman T, Lefrancois L. Expression of the gamma-delta T-cell receptor on intestinal CD8+ intraepithelial lymphocytes. Nature 1988;333:855-858
15 Qin HY, Elliott JF, Lakey JR y col. Endogenous immune response to glutamic acid decarboxylase (GAD67) in NOD mice is modulated by adjuvant immunotherapy. J Autoimmun 1998; 11: 591-601.
16 Bonifacio E, Lampasona V, Bingley PJ. IA-2 (islet cell antigen 512) is the primary target of humoral autoimmunity against type 1 diabetes- associated tyrosine phosphatase autoantigens. J Immunol 1998; 161: 2648-54
17 Derbinski J, Schulte A, Kyewski B, Klein L. Promiscuous gene expre-ssion in medullary thymic epithelial cells mirrors the peripheral self. Nat Immunol 2001;2:1032-1039
18 Zuklys S, Balciunaite G, Agarwal A, Fasler-Kan E, Palmer E, Hollander GA. Normal thymic architecture and negative selection are associated with Aire expression, the gene defective in the autoimmune-polyendocrinopathy-candidiasis-ectodermal dystrophy (APECED). J Immunol 2000;165:1976-1983
19 Bjorses P, Aaltonen J, Horelli-Kuitunen N, Yaspo ML, Peltonen L. Gene defect behind APECED: a new clue to autoimmunity. Hum Mol Genet 1998;7:1547-1553
20 A. Weiss, R. Shields, M. Newton, B. Manger, J. Imboden. Ligand-receptor interactions required for commitment to the activation of the interleukin-2 gene J. Immunol 1987; 138: 2169
21 Lyons DS, Lieberman SA, Hampl J, Boniface JJ, Chien Y, Berg LJ, Davis MM. A TCR binds to antagonist ligands with lower affinities and faster dissociation rates than to agonists. Immunity 1996; 5 (1):53-61
22 Wang W, Gulden PH, Pierce RA, Shabanowitz J, Man ST, Hunt DF, Engelhard VH, Shabanowitz JA. A naturally processed peptide presented by HLA-A*0201 is expressed at low abundance and recognized by an alloreactive CD8+ cytotoxic T cell with apparent high affinity. Journal of Immunology, 1997;158, (12) 5797-5804.
23 Springer TA. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell 1994;76 (2):301-14.
24 Sanchez-Madrid F, del Pozo MA. Leukocyte polarization in cell migration and immune interactions. Embo J. 1999; 18: 501-11
25 Spiegel S, Kassis S, Wilchek M, Fishman Kucik DF, Dustin ML, Miller JM, Brown EJ. Adhesion activating phorbol ester increases the mobility of leukocyte integrin LFA-1 in cultured lymphocytes. J. Clin. Invest. 1996; 97:2139-44
26 Najafian N, Sayegh MH. CTLA4-Ig: a novel immunosuppressive agent. Expert Opin Investig Drugs 2000;9:2147-2157
27 Abbas, A.K, Lichtman. A.H., Pober, J.S.: 4. Cellular & molecular immunology. London, W. B. Saunders Comp. 2000, 553 p.
28 Unanue ER.Antigen-presenting function of the macrophage. Annu Rev Immunol 1984;2:395-42
29 Las imágenes en video pueden ser visualizadas en www.sciencemag.org /feature/data/1040037.shl.
30 Grakoui A, Bromley SK, Sumen C, Davis MM, Shaw AS, Allen PM, Dustin ML.The immunological synapse: A molecular machine controlling T cell activation. Science 1999; 285:221-27
31 Brown DA, London E. Structure and function of sphingolipid- and cholesterol-rich membrane rafts. J. Biol. Chem. 2000; 275:17221-24
32 Kersh EN, Shaw AS, Allen PM. Fidelity of T cell activation through multistep T cell receptor zeta phosphorylation. Science 1998;281:572-75
33 Timmerman LA, Clipstone NA, Ho SN, Northrop JP, Crabtree GR.. Rapid shuttling of NF-AT in discrimination of Ca2+ signals and immunosuppression. Nature 1996; 383(6603):837-40
34 Valututti S, Muller S, Cella M, Padovan E, Lanzavecchia A. Serial triggering of many T-cell receptors by a few peptide-MHC complexes. Nature 1995; 375:148-51
35 Davis AL, McKenzie JL, Hart DNJ: HLA-DR positive leukocyte subpopulations in human skin include dendritic cells, macrophages and CD7-negative T cells. Immunology 1988; 65:573
36 Arstila TP, Casrouge A, Baron V, Even J, Kanellopoulos J, Kourilsky P. A Direct Estimate of the Human alfa betaT Cell Receptor Diversity. Science 1999; 286, (5441): 958-961.
37 Muramatsu M. et al., Class switch recombination and hypermutation require activation-induced cytidine deaminase (AID), a potential RNA edi-ting enzyme. Cell, 2000; 102:553-63
38 Revy P et al., Activation-induced cytidine deaminase (AID) deficiency causes the autosomal recessive form of the hyper-IgM syndrome (HIGM2), Cell, 2000; 102:565-75
39 M.A. Oettinger et al., RAG-1 and RAG-2, adjacent genes that synergistically activate V(D)J recombination, Science, 1990; 248:1517-23
40 Bach J-F. The effect of infections on susceptibility to autoimmune and allergic diseases. N Engl J Med 2002;347:911-920
41 Egen JG, Kuhns MS, Allison JP. CTLA-4: new insights into its biological function and use in tumor immunotherapy. Nat Immunol 2002;3:611-618.
42 Lipsky PE, van der Heijde DMFM, St Clair EW, et al. Infliximab and methotrexate in the treatment of rheumatoid arthritis. N Engl J Med 2000;343:1594-1602
43 Present DH, Rutgeerts P, Targan S, et al. Infliximab for the treatment of fistulas in patients with Crohn's disease. N Engl J Med 1999;340:1398-1405
44 Abrams JR, Lebwohl MG, Guzzo CA, et al. CTLA4Ig-mediated blockade of T-cell costimulation in patients with psoriasis vulgaris. J Clin Invest 1999;103:1243-1252
45 Kamradt T and Mitchison NA. Tolerance and Autoimmunity. N Engl J Med. 2001 344:655-66
46 Bielekova B, Goodwin B, Richert N, et al. Encephalitogenic potential of the myelin basic protein peptide (amino acids 83-99) in multiple sclerosis: results of a phase II clinical trial with an altered peptide ligand. Nat Med 2000;6:1167-1175
|

