|
RESUMEN
Este trabajo tiene por objeto investigar la presencia de una alteración genética en el codón que codifica para el receptor del glucagón en una población no caucásica. Dicha alteración consiste en la mutación Gli 40 Ser. Para ello se estudiaron 50 pacientes con diabetes mellitus (DM) tipo 2 de origen étnico no caucásico procedentes del noroeste Argentino, Paraguay, Perú y Bolivia, con antecedentes familiares de DM en por lo menos un familiar de primer grado y con más de dos años de DM conocida. La muestra fue comparada con un grupo control de igual estratificación étnica y sin DM.
Se obtuvo sangre venosa de cada sujeto y se procesó del siguiente modo: se purificó ADN genómico de leucocitos de sangre periférica por la técnica de Proteinasa K-SDS y se amplificó el segundo exón del gen del RG por PCR con primers específicos. Se utilizaron como pruebas de significación estadística el test de chi cuadrado para cuadros de contingencia de dos por dos, así como parámetros de estadística descriptiva. Se estableció un error alfa de 0,05 y un error beta de 0,90. Se cumplieron los reparos éticos de una investigación científica en seres humanos.
La mutación Gly 40 Ser fue observada de manera estadísticamente significativa (p < 0.05) en los pacientes diabéticos de la población estudiada. El 58% de los pacientes presentaba complicaciones diabéticas siendo las más frecuentes la retinopatía y la arteriopatía periférica. Si bien algunos estudios muestran una relación entre la carga genética y el tipo de complicación, esta relación no fue evidenciada por nosotros.
Finalmente, consignamos que el método bioquímico utilizado permite la detección de mutaciones puntuales así como pequeñas inserciones o deleciones por lo que puede ser aplicado satisfactoriamente en grandes poblaciones con fines de tamizado (screening).
SUMMARY
The purpose of this work is the investigation of the presence of a genetic alteration in the codon that codes for the receiver of the glucagon in a non caucasian population. This alteration consists on the mutation Gli 40 Ser. For this purpose, 50 patients with type 2 diabetes mellitus (DM), ethnic origin not caucasian coming from the Argentinean Northwest, Paraguay, Peru and Bolivia, with family antecedents of DM in at least a first degree parent and with two years or more of DM known were studied. The sample was compared with a control group with the same ethnic stratification and without DM.
Veined blood of each patient and control was obtained and it was processed in the following way: became purified DNA genomic of leukocytes of outlying blood for the technique of Proteinas K-SDS and the second exon of the gene of the RG was amplified by PCR with specific primers. They were used as tests of statistical significance the test of square chi for squares of contingency two for two, as well as parameters of descriptive statistic. We settled down an error alpha of 0,05 and an error beta of 0,90. The ethical repairs of a scientific investigation were completed.
The mutation Gly 40 Ser was observed, in way statistically significant (p < 0.05), in the diabetic patients; 58% of the patients presented diabetic complications, being the most frequent the retinopathy and the macroangiopathy. Although some studies show a relationship between the genetic load and the complication type, this relationship was not evidenced by us.
Finally, we consign that the used of the biochemical method allows the detection of mutations punctual as well as small inserts or delecions; so it can be applied satisfactorily in big populations with purpose of having sifted
(screening).
Introducción
La diabetes tipo 2 es una enfermedad metabólica que afecta aproximadamente al 7% de la población; presenta una marcada heterogeneidad clínica y genética. La diabetes mellitus no insulino dependiente (DMNID) responde a factores ambientales y genéticos. Estos factores genéticos son múltiples y no hay correlación entre un determinado genotipo y un determinado fenotipo. El riesgo estimado entre personas relacionadas genéticamente varía de acuerdo al grado de parentesco. En la relación terciaria se comparte el 12,5% de los genes, en la secundaria el 25%, en la de primer grado el 50% y en los gemelos univitelinos es del 100%1. Estudios en grupos familiares y en gemelos han establecido una etiología genética de la enfermedad; siendo la herencia de tipo poligénico2. Desde un punto de vista etiopatogénico, los pacientes presentan hiposecreción de insulina, resistencia periférica a la acción de la insulina y aumento de la producción hepática de glucosa, posiblemente por resistencia hepática a la insulina. Estas diferentes alteraciones tienen una reconocida base genética, la que confiere susceptibilidad para la diabetes tipo 2, y frente a los factores ambientales desencadenantes se produce el comienzo clínico de la enfermedad3.
Se ha establecido una importante diferencia en cuanto a la prevalencia de mutaciones genéticas en diferentes grupos étnicos y poblacionales con diabetes tipo 2, lo que establece la necesidad de determinar la frecuencia de las mismas en la propia población, debido a la heterogeneidad genética particular de la enfermedad4. La estrategia de los genes candidatos biológicos ha sido tradicionalmente el camino utilizado para establecer las alteraciones genéticas que causan la enfermedad, para lo cual se debe tener en cuenta la fisiopatología de la diabetes tipo 2 y en base a ella identificar a los posibles genes relacionados5. Hasta el presente se ha determinado la participación de genes cuyas mutaciones se relacionan con resistencia periférica a la insulina, como los genes de insulina, receptor de insulina, sustrato del receptor de insulina 1, glucógeno sintetasa, y aquellos cuyas mutaciones determinan disminución en la secreción de insulina como genes del genoma mitocondrial, gen de la glucoquinasa, factor nuclear hepático 4ð, factor nuclear hepático 1ð, que han aclarado, en pequeña medida, la etiología de la enfermedad; de todas maneras, las diferentes mutaciones referidas representan menos del 10% de los casos de diabetes tipo 2 según las diferentes poblaciones6.
El glucagón, secretado por las células alfa de los islotes del páncreas en respuesta a niveles bajos de glucemia, es una hormona que interviene en la homeostasis de la glucemia, por aumentar la producción hepática de glucosa y, a su vez, estimular la secreción de insulina por unión a su propio receptor7. El efecto biológico del glucagón se lleva a cabo a través de su receptor expresado en la membrana plasmática de los tejidos blanco; éste pertenece a la superfamilia de receptores acoplados a proteína G, que transmiten la señal dentro de la célula por aumento de cAMP, así como la liberación de calcio citosólico.8 El gen del receptor de glucagón (RG) fue clonado y secuenciado en 1994, a partir de lo cual se logra un mayor entendimiento de la regulación de la glucemia. Este hallazgo contribuirá a develar las bases genéticas de la diabetes tipo 2. El gen del RG mapea en el cromosoma 17q25, su región codificante tiene 5.5 Kb representada por 13 exones9.
El RG tiene 7 dominios transmembrana, el dominio carboxiterminal es intracelular y el dominio aminoterminal es extracelular10. Debido al rol central que cumple el glucagón en la homeostasis de la glucemia y a la reciente demostración de la disminución de la expresión del gen del RG, tanto en tejido hepático como en la célula ß del páncreas ante la hiperglucemia11, el gen del RG ha sido considerado un gen candidato para determinar el desarrollo de diabetes tipo 2. Hager y col. reportan una mutación en el gen del RG en el codón 40 GGT Glicina (Gly) por AGT Serina (Ser) presente en el 4% de la población francesa y en el 8% de la población italiana de Cerdeña12. Esta mutación está localizada en el dominio extracelular del RG, se ha demostrado que la misma reduce la unión del glucagón con el receptor y por lo tanto se altera la transmisión de la señal biológica intracelular del glucagón13. La mutación en cuestión ha sido reportada con grandes diferencias de prevalencia
en los distintos grupos étnicos y entre las diferentes poblaciones de un mismo grupo étnico14.
Dado que una mutación puntual que implicaría un cambio de glicina por serina en el codón 40 del receptor de glucagón es causa posible de diabetes tipo 2 y, dado que según la bibliografía consultada, la prevalencia de este gen alterado varía en los diferentes grupos étnicos, decidimos investigar la presencia de esta mutación genética en grupos étnicos del noroeste Argentino, Paraguay, Perú y Bolivia.
En este marco, nuestros objetivos fueron:
• Investigar la presencia de la mutación Gli 40 Ser en el gen del receptor del glucagón, en la población aborigen diabética del noroeste Argentino, Paraguay, Perú y Bolivia.
• Establecer la relación de esta mutación con la génesis de la Diabetes tipo 2.
• Describir las complicaciones clínicas de la diabetes y su posible relación con la presencia o ausencia de dicho gen.
Tabla N°
1. Muestra problema.
( n: 50 ).
Edad de los pacientes
| EDAD |
| 1 |
20 |
26 |
62 |
| 2 |
25 |
27 |
62 |
| 3 |
41 |
28 |
62 |
| 4 |
43 |
29 |
63 |
| 5 |
46 |
30 |
63 |
| 6 |
47 |
31 |
64 |
| 7 |
48 |
32 |
65 |
| 8 |
49 |
33 |
66 |
| 9 |
50 |
34 |
67 |
| 10 |
52 |
35 |
67 |
| 11 |
53 |
36 |
68 |
| 12 |
53 |
37 |
68 |
| 13 |
54 |
38 |
68 |
| 14 |
54 |
39 |
69 |
| 15 |
55 |
40 |
69 |
| 16 |
55 |
41 |
70 |
| 17 |
58 |
42 |
71 |
| 18 |
59 |
43 |
72 |
| 19 |
60 |
44 |
72 |
| 20 |
60 |
45 |
72 |
| 21 |
61 |
46 |
74 |
| 22 |
61 |
47 |
76 |
| 23 |
61 |
48 |
76 |
| 24 |
61 |
49 |
77 |
| 25 |
61 |
50 |
78 |
Tabla 2 Muestra Problema
(n: 50)
Sexo
| Sexo |
| Varones |
20 |
| Mujeres |
30 |
Tabla 3. Muestra problema.
Distribución por sexo y edad
| Edad |
Varones |
Mujeres |
| 20 |
1 |
|
| 25 |
1 |
|
| 41 |
1 |
|
| 43 |
|
1 |
| 46 |
|
1 |
| 47 |
1 |
|
| 48 |
1 |
|
| 49 |
1 |
|
| 50 |
|
1 |
| 52 |
|
1 |
| 53 |
2 |
|
| 54 |
|
2 |
| 55 |
1 |
1 |
| 58 |
|
1 |
| 59 |
|
1 |
| 60 |
1 |
1 |
| 61 |
3 |
2 |
| 62 |
2 |
1 |
| 63 |
|
2 |
| 64 |
|
1 |
| 65 |
1 |
|
| 66 |
|
1 |
| 67 |
|
2 |
| 68 |
1 |
2 |
| 69 |
|
2 |
| 70 |
1 |
|
| 71 |
1 |
|
| 72 |
|
3 |
| 74 |
|
1 |
| 76 |
2 |
|
| 77 |
|
1 |
| 78 |
|
1 |
| total |
20 |
30 |
Tabla 4. Estadística descriptiva de la
edad de la muestra problema
| Rango |
Mínimo |
20 |
| |
Máximo |
78 |
| Mediana |
|
61 |
| Media |
|
56 |
| Desvío Est. |
|
12 |
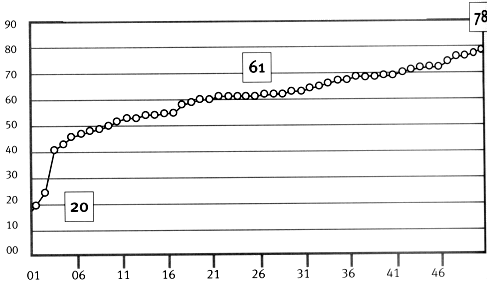
Figura
1- Muestra Problema
(nº 50)
Distribución etaria de la población
Figura
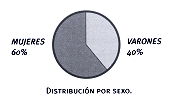
2. Muestra problema
(Nº 50) Distribución por sexo
Figura
3 Muestra Problema. Relación entre sexo y edad 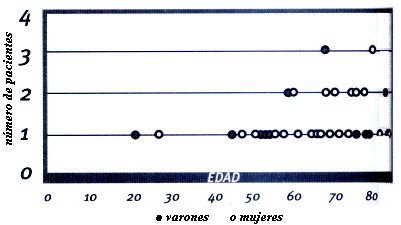
Población y muestra
La población muestreada, estuvo integrada por pacientes ambulatorios que concurren al Consultorio Externo de Diabetología del Hospital de Agudos Parmenio Piñero. Se consideraron dos muestras aleatorias estratificadas, una problema y otra control. En la muestra problema se incluyeron 50 pacientes que debieron cumplir los siguientes criterios de inclusión:
• Diabetes mellitus tipo 2.
• Origen étnico no caucásico del noroeste Argentino, Bolivia, Paraguay y Perú.
• Antecedentes heredofamiliares de diabetes en por lo menos un familiar de primer grado (padres o hermanos).
• Más de dos años de antigüedad de la diabetes.
Fueron criterios de exclusión los siguientes:
• Diabetes tipo 1.
• Diabetes tipo 2 con origen étnico distinto al referido.
• Diabetes tipo 2 sin antecedentes heredofamiliares de primer grado.
• Embarazo.
Esta población fue comparada con 50 individuos controles, con el mismo origen étnico, con glucemia normal en ayunas y sin antecedentes familiares de diabetes. Se tuvo especial cuidado en la selección de la muestra control en relación con el origen étnico de sus integrantes para que las muestras fueran comparables.
Tabla 5. Muestra problema
(n: 50) Estratificación de la muestra
| Grupo |
Aborigen |
| Abipón-Tonocote-Mocoví |
12 |
| Cacan-Quichua |
11 |
| Colla-Aymara |
5 |
| Comechingones |
4 |
| Guaraní |
10 |
| Mapuche-Huarpe |
2 |
| Toba |
6 |
Tabla 6. Muestra control
(n: 50) Estadística Descriptiva de la Edad
| Rango |
Mínimo |
17 |
| |
Máximo |
82 |
| Mediana |
62 |
| Media |
60 |
| Desvio Est. |
16 |
Tabla 7. Muestra control (n: 50) Descripción por sexo
| Sexo |
| varones |
23 |
| mujeres |
27 |
Tabla 8. Muestra control
(n:50). Estratificación de la muestra
| Grupo |
Aborigen |
| Abipón-Tonocote-Mocoví |
11 |
| Cacan-Quichua |
9 |
| Colla-Aymara |
6 |
| Comechingones |
5 |
| Guaraní |
11 |
| Mapuche-Huarpe |
3 |
| Toba |
5 |
Material y Métodos
La pertenencia a los diferentes grupos aborígenes (tobas, matacos, guarayos, quechuas, etc.), se determinó en referencia a criterios socio – culturales que se comentan en la discusión y no de acuerdo con la nacionalidad política . Para ello se contó con asesoramiento antropológico.
A cada sujeto del grupo problema así como a cada uno del grupo control se le extrajo sangre venosa de modo convencional. Las muestras fueron criopreservadas hasta su procesamiento. También se elaboró una ficha de datos por cada paciente en la que se registraron las siguientes variables: edad, sexo, tiempo conocido de evolución de la diabetes, complicaciones
(nefropatía, retinopatía, neuropatía, ACV, cardiopatía, enfermedad vascular periférica), antecedentes familiares de diabetes (de primer grado y de segundo), tratamiento (dieta, dieta con hipoglucemiantes orales, dieta con insulina), lugar de procedencia y resultado de las pruebas genéticas.
El procesamiento de las muestras de sangre periférica consistió en lo siguiente: se purificó ADN genómico de leucocitos de sangre periférica por la técnica de Proteinasa K-SDS y se amplificó el segundo exón del gen del RG por PCR con primers específicos.
Las condiciones para la amplificación por PCR, fueron: desnaturalización inicial: 94º C durante 5', desnaturalización: 94º C durante 1', annealing: 62º C durante 1', extensión: 72º C durante 1', extensión final: 72º C durante 5'. Duración de la reacción de PCR: 35 ciclos.
El producto de amplificación, fue digerido con 20 U de la enzima de restricción BstEII (marca New England Biolabs), y los productos de digestión fueron sometidos a electroforesis en geles de poliacrilamida al 12 % o en geles de agarosa al 3%. El producto de amplificación de PCR también fue analizado por la técnica de Single Strand Conformation Polymorphism (SSCP), lo que permite la identificación de mutaciones por cambios en la estructura conformacional del producto de amplificación en la corrida
electroforética en geles de poliacrilamida. Los productos de amplificación por PCR, se desnaturalizaron a 95º C durante 10', previamente a la electroforesis y luego la misma se llevó acabo en geles de poliacrilamida al 10% con 10% de glicerol. Se utilizaron como pruebas de significación estadística el test de chi cuadrado para cuadros de contingencia de dos por dos, así como parámetros de estadística descriptiva. Se estableció un error alfa de 0,05 y un error beta de 0,90.
Reparos éticos
Cada paciente fue debidamente informado sobre las características de este trabajo clínico, obteniéndose del mismo su consentimiento por escrito. Este protocolo contó con la aprobación del Comité de Docencia e Investigación y con la del Comité de Ética del Hospital P. Piñero.
Resultados
Los pacientes del grupo problema tenían entre 20 y 78 años con una media de 56 +/- 12 y una mediana de 61. Dos casos (4%) presentaron la mutación. De ellos, 30 (60%) eran mujeres y 20 (40%) eran varones. La estratificación de la muestra en relación con el grupo étnico, se aprecia en la tabla Nº5 y en la figura Nº3. El 82% de los pacientes recibía como tratamiento tanto dieta como hipoglucemiantes orales (HGO), el 6% se controlaba sólo con dieta y el 12% recibía junto con la dieta insulinoterapia.
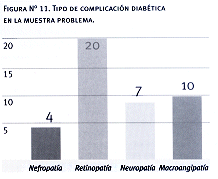
Observamos complicaciones en 29 pacientes (58%), no existiendo diferencias significativas entre varones y mujeres. La principal complicación hallada fue la retinopatía, siguiendo en orden de frecuencia la macroangiopatía a predominio arterial (70% arteriopatía vs 30% coronariopatía).
El grupo control tenía edades comprendidas entre 17 y 82 años con una media de 60 +/- 16 y una mediana de 62. De los 50 controles, 23 eran varones y 27 mujeres. En ningún caso se observó la mutación.
En las tablas y gráficos que se adjuntan se exponen los resultados hallados.
Los pacientes con DMNID y resultados positivos eran heterocigotos para la mutación, presentando un patrón de tres bandas luego de la electroforesis en geles de poliacrilamida al 12%. Las bandas observadas tenían un PM de 88 pb y 108 pb correspondientes al producto de digestión normal, y la banda de 196 pb al del alelo mutado que perdió el sitio de reconocimiento para la enzima debido a la mutación y, por lo tanto, no fue digerido
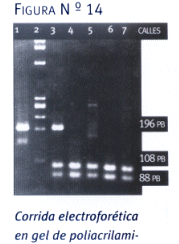
(figura 13). Los productos de amplificación del exón 2 del gen RG también fueron analizados mediante la técnica de SSCP. En la
(figura 14) se observa la diferencia en el patrón de bandas después de la corrida electroforética del fragmento de amplificación, correspondiente a los pacientes diabéticos en comparación con un individuo no diabético homocigota normal para la mutación.
Discusión
Aclararemos el concepto de "grupo étnico aborigen relacionado" que hemos utilizado en este trabajo. Todos los conceptos antropológicos que permiten agregar a los grupos humanos en categorías biológicas más o menos homogéneas se prestan al debate teórico y a la discusión ideológica. Sin embargo, en investigaciones como ésta se hace necesario aplicar algún criterio de agrupación que permita fijar, por el origen geográfico y ciertos hábitos sociales, grupos de población humana de unidades más pequeñas de variación regional.
Aplicar un criterio biológico para adscribir a un grupo "étnico" a los individuos de la muestra, significaría hacer una secuencia de estudios de alianza (con quién se casan) y de consanguinidad (de quién son parientes) para cada localidad. Más allá de que una tarea de este tipo excede los objetivos propuestos para esta investigación, el principal problema es que, en muchos casos, las comunidades de origen de los sujetos de estudio son sociedades formadas por generaciones de inmigrantes de varios orígenes y dado que no sabemos cómo viven no podemos saber si se casan o tienen hijos unos con otros o no. Ese es el caso de, por ejemplo, Presidencia Roque Sáenz Peña en el Chaco. Esa localidad tiene población criolla, toba, croata y eslovena. Por lo tanto, no podemos arriesgarnos a darle una pertenencia étnica a un sujeto sin saber antes cómo son las reglas matrimoniales entre estas colectividades, es decir si se mezclan o no y entre quiénes se mezclan.
Algo parecido sucede en Tinogasta y Belén en Catamarca con la inmigración sirio libanesa. Hay criollos, sirios y libaneses y tres generaciones de mestizos. A los criollos les dicen collas, pero su "verdadero origen histórico" no puede determinarse por el patronímico (el apellido) porque no fue tomado como dato relevante. Es más, si lo tuviésemos se trataría de un indicador con mucho margen de error (casos de hijos no reconocidos o adoptados por arreglos extralegales anotados como propios). Algo parecido ocurriría si tomáramos como indicador el fenotipo, dado que es un dato vago y muy poco confiable de lo que "realmente" están transmitiendo los genes15.
En algunos estudios que citaremos (los llevados a cabo en Finlandia y Japón, por ejemplo), el criterio de selección pasó por el fenotipo y, en vista de las consideraciones precedentes, la muestra se encuentra, a nuestro entender, sesgada. Otros estudios utilizan como demarcación poblacional los límites geopolíticos (tal es el caso de los realizados en Cerdeña y en Francia). Desde un punto de vista antropológico, si bien en algunos casos es posible que exista una coincidencia entre nación, cultura y grupo étnico, ello no es lo habitual. Desde siempre los grupos humanos han hecho un intercambio genético basado en la prohibición del incesto. Este intercambio se ha acrecentado en forma exponencial en los últimos siglos en relación con los viajes intercontinentales, el comercio y la colonización. Por lo tanto, creemos que estos trabajos también presentan un sesgo en la selección de la muestra. Aunque sabemos, como venimos diciendo, que no existen grupos étnicos genéticamente "puros", consideramos que nuestro estudio apeló a criterios que, aunque no absolutamente, permiten una agupación étnica más fiable.
Si bien estudios de inmunogenética nos permitirían tomar marcadores genéticos de "aboriginalidad" americana en poblaciones actuales aluvionales como el grupo sanguíneo 0 ó ciertas particularidades del sistema inmune, esto haría necesaria una investigación específica. En función de los problemas expuestos, para definir las unidades más pequeñas dentro del grupo en estudio preferimos aplicar, por ser más amplios y flexibles, criterios socio-culturales. Sin embargo esta opción tampoco se nos presentó libre de dificultades.
En el caso de los grupos étnicos de América hay varios sistemas de clasificación sociocultural que se superponen, entre otros: lingüístico, territorial, por autoadscripción (v.g. wichi), adscripción por otro (de "wichi" que es como se llaman ellos a sí mismos, "mataco" que es como los designaron los colonizadores) y algunos nombres que surgieron de la interpretación arqueológica como "diaguita o draconiano".
Figura 4
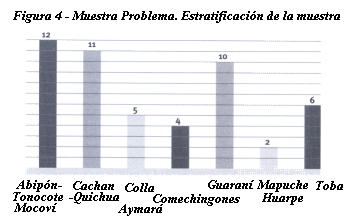
Figura 5
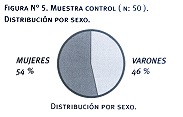
Figura 6
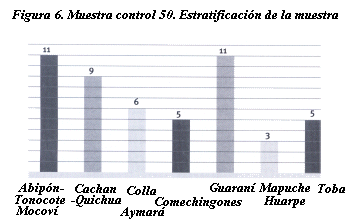
Tabla 9. Muestra problema
(n:50) Tratamiento recibido
|
Tratamientos |
| Dieta |
Dieta+Hipoglucemiantes
orales |
Dieta+Insulina |
| 6 |
42 |
3 |
A los fines de esta investigación, se optó por la tipología de grupos lingüísticos, por ser estos más extendidos geográficamente, y remitir a una región donde se supone que la gente circula y se entiende porque hablan el mismo idioma. En el mismo sentido, puede sostenerse que históricamente por ejemplo grupos chanés y charrúas hablaron guaraní. O que calchaquíes y hualfines, cacan. Del mismo modo que huarpes y puelches terminaron hablando mapuche porque comerciaban y disputaban territorio con ellos. Esta clasificación por lo amplia, tiene menos margen de error. Asimismo, este agrupamiento deja espacio para suponer que dentro de esos grupos lingüísticos pueden o no aparecer otros subgrupos originados por la aplicación de otras reglas de apareamiento y herencia, tengan o no denominación, según el caso.
Esta clasificación es la que se aplicó al agrupar a la muestra de población en subgrupos denominados "grupo étnico aborigen relacionado". Pero esta clasificación no debe entenderse como una categoría que da atributos homogéneos a un grupo social ni que determina comportamientos. En las poblaciones humanas, a diferencia de lo que ocurre en otras especies donde puede suponerse que ocurren apareamientos al azar, genotipo y fenotipo se transmiten siempre por aplicación de pautas y causas de parentesco (alianza, filiación y consanguinidad) establecidas culturalmente, que varían a lo largo de la historia.
Figura 7
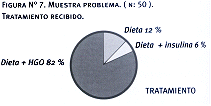
Figura 8
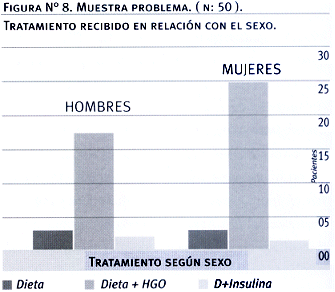
Figura 9
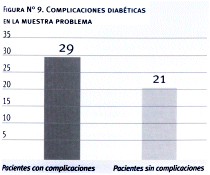
Figura 10

Figura 11
Para el concepto de grupos étnicos o etnias elegimos el origen teórico que creemos más operativo para pensarlo en función de la permanente y no determinada forma en que se vinculan los grupos humanos en su interacción social. Esto es, creemos que no puede hacerse una definición esencialista por atributos del tipo "ser colla es: tener el pelo negro, la tez morena, tener muchos hijos, tomar chicha y vivir en la Sierra de Bolivia". Cada población (en el sentido en que es estudiada por la genética de poblaciones, como grupo parcialmente endogámico) tiene una forma de organizar su reproducción social. Dentro de esa forma están las reglas matrimoniales, los casamientos preferidos, los prohibidos y todo ese minúsculo juego de reglas es el que va haciendo que algunos grupos sean más homogéneos hacia adentro respecto de otros grupos. Esto hace que, por ejemplo, ser colla en Jujuy o Bolivia no sea lo mismo que en el Mercado Central de Buenos Aires o en Florencio Varela16.
Figura 12

Figura 13
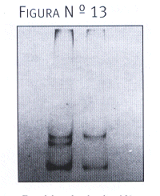
Figura 14
Tabla
10. Muestra
problema. (n:50) Tratamiento recibido en relación con el sexo
| Hombres |
Mujeres |
| Dieta |
3 |
3 |
| D+HGO |
15 |
26 |
| D+Insulina |
2 |
1 |
Tabla 11. Complicaciones diabéticas en la muestra problema de acuerdo
al sexo.
| Complicaciones |
| |
Varones |
Mujeres |
Total |
| SI |
11 |
17 |
28 |
| NO |
9 |
13 |
22 |
| Total |
20 |
30 |
50 |
Tabla 12. Tipo de
complicación diabética en relación al sexo en la muestra problema
| Complicaciones
- Sexo |
| Nefropatía |
VARONES 0 |
MUJERES 4 |
| Retinopatía |
VARONES 8 |
MUJERES 11 |
| Neuropatía |
VARONES 2 |
MUJERES 5 |
| Cardiopatía |
VARONES 0 |
MUJERES 3 |
| ACV |
VARONES 0 |
MUJERES 0 |
| Arteriopatía |
VARONES 3 |
MUJERES 7 |
Desde el punto de vista biomédico, el comienzo y desarrollo de la diabetes mellitus no-insulino dependiente (NIDDM) se debe a una interacción compleja entre genes y medio ambiente por un lado y, por otro lado a la interacción entre los defectos metabólicos en varios tejidos, a saber: el tejido pancreático a nivel de la célula beta (disminución de la secreción de insulina), el músculo esquelético (resistencia a la insulina), el hígado (aumento de la gluconeogénesis), el tejido adiposo (aumento de la lipólisis) y posiblemente el intestino con diversas hormonas (péptido 1 símil glucagón (GLP1).
La evidencia para un componente genético incluye: el hallazgo de una variedad de defectos metabólicos en diversos tejidos de sujetos no diabético con predisposición genética para la DMNID, peor tolerancia a la sobrecarga de glucosa en hermanos monocigotas comparado con gemelos dicigotas y, más recientemente, la demostración de genes con diferente susceptibilidad para los sitios Substrato 1 (IRS1) del receptor de insulina, el receptor beta-3 adrenérgico, y el receptor de sulfonilurea. Sin embargo, la predisposición genética solo explica una proporción menor de DMNID en la población general, y la magnitud en que los factores genéticos contra los factores no genéticos contribuyen al desarrollo de la enfermedad es una controversia aún no resuelta.
Los factores medioambientales incluyen tanto un componente intrauterino temprano asociado con peso bajo al nacer, cuanto componentes postnatales más tardíos tales como actividad física baja, lípidos elevados, alteraciones en la dieta con el desarrollo subsecuente de obesidad y niveles altos en plasma y tejidos de ácidos grasos libres. La asociación entre bajo peso al nacer y DMNID podría explicarse postulando la existencia de un gen común que causa ambos fenómenos.
Los parientes de primer grado de pacientes con DMNID presentan hiperinsulinemia y resistencia periférica a la insulina; ésta, a su vez, puede explicarse por una disminución de la activación de la insulina sobre la glucógeno sintetasa del músculo esquelético. Por consiguiente, este defecto en el músculo esquelético puede representar una expresión fenotípica temprana de un defecto genético que contribuye a un mayor riesgo de desarrollo tardío de DMNID. Sin embargo, dicha alteración en la activación de la glucógeno sintetasa tendría un componente no genético claro que, a su vez, desempeñaría un papel fundamental en el desarrollo de la enfermedad aún en aquellos con una predisposición genética del 100%17.
Como venimos diciendo, la diabetes tipo 2 es un desorden heterogéneo. La expresión clínica del desorden requiere tanto de factores genéticos como medioambientales. Una teoría etiológica sostiene que es el resultado de la evolución de un genotipo "económico" que era beneficioso para la supervivencia en el pasado pero que es perjudicial en el ambiente actual. Una teoría contraria afirma que representa una respuesta metabólica adulta a la desnutrición fetal. Se sabe que la hiperglucemia en el tipo 2 de diabetes es el resultado de la deficiencia de insulina absoluta o relativa. Más a menudo se trata de una deficiencia de insulina relativa que es atribuible a una resistencia a la insulina. La resistencia a la insulina puede ser causada por una variedad de factores genéticos o metabólicos18.
Un tratamiento definitivo para la diabetes será uno que mantenga la concentración de glucosa en sangre normal ante la ingestión dietética fluctuante. El postular una teoría genética para explicar la causa de esta enfermedad ofrece el atractivo de la posibilidad de poder alcanzar ese tratamiento definitivo. El mejor tratamiento probablemente será, entonces, aquel basado en la modificación genética de células. Éstas podrían ser las células beta pancreáticas ya que son las únicas que producen
insulina, o también otras células que están involucradas en la patogénesis de la diabetes. Una terapia génica tal tendría la ventaja sobre los tratamientos convencionales de "curar" en lugar de "controlar" la enfermedad.
Aunque el tratamiento definitivo que use las células genéticamente modificadas es una meta a largo plazo, mucho se está progresando en este sentido 19. Diversos genes involucrados en la patogenia de esta afección se volverán los blancos para la ingeniería genética en las células beta del diabético20. Recientemente, también se ha generado un vector retroviral conteniendo el cDNA de la proinsulina humana asi como el gen que codifica para el receptor del factor de crecimiento humano21.
El interés por explicar genéticamente la diabetes junto a la elevada prevalencia de la enfermedad en grupos familiares y en poblaciones que se han mantenido más o menos aisladas, llevó a los investigadores a realizar estudios en diferentes grupos étnicos. Dado que el glucagón, como hormona contrarreguladora, desempeña un papel importante en la homeostasis del metabolismo glúcido, recientemente se ha encontrado que la mutación Gly 40 Ser en el receptor para esta hormona se encuentra en pacientes con DMNID en Francia y en Cerdeña con una frecuencia de 4,6% y de 8,3% respectivamente. Esta mutación también fue asociada a hipertensión arterial esencial en el 5,4%. A continuación citamos las conclusiones de algunos de estos trabajos:
• Se investigó la presencia de la mutación Gly 40 Ser en 383 pacientes con DMNID y en 53 con DMID entre la población japonesa. No se evidenció la mutación en ningún caso22.
• Se estudiaron 200 pacientes con DMNID de origen japonés no hallándose la mutación en ningún caso23.
• Se estudió la frecuencia de la mutación de Gly 40 Ser en diferentes regiones de Cerdeña así como las implicancias fisiopatológicas de esta mutación en la homeostasis de glucosa / insulina. Para ello se seleccionaron 691 sujetos sobre la base de su origen cerdeño, 574 con DMNID y 117 no diabéticos. El 3, 6% (21 pacientes) presentó la mutación en forma heterocigota. En el grupo control la mutación apareció en 5 sujetos. Se concluyó que existe asociación entre dicha mutación y la DMNID. Curiosamente, la distribución de la mutación no fue homogénea en toda la isla, observándose la mayor frecuencia en el sur y luego en el norte; la zona central, con población más arcaica y genéticamente más homogénea, presentó la menor cantidad.
Con respecto al papel fisiológico, el estudio concluye que, in vivo, la sustitución del aminoácido en el receptor del glucagón podría conducir incluso a un descenso de los niveles de glucemia como consecuencia de un descenso de la producción hepática de glucosa. Como este receptor se encuentra también en las células beta se ha postulado que estimularían la secreción de insulina y que su mutación tendría el efecto contrario. Sin embargo, en este estudio no se evidenció una disminución en la secreción de insulina durante la infusión de concentraciones crecientes de glucagón en rango fisiológico24.
• En Holanda, se estudiaron 96 pacientes diabéticos y 96 controles pertenecientes a población caucásica entre 35 y 75 años. En ninguno de ellos se halló la mutación25.
• En la población finlandesa se estudiaron 311 pacientes con DMNID, 101 con tolerancia anormal a la glucosa y 306 controles. No pudo demostrarse la presencia de polimorfismo Gly 40 Ser en los pacientes diabéticos aunque sí se observó en 4 controles que resultaron ser heterocigotas para dicho gen26.
• Un estudio llevado a cabo en Taiwán evaluó la presencia de la mutación en cuestión entre 213 pacientes con DMNID, 107 pacientes con hipertensión esencial y 121 controles normales, mediante la técnica de PCR – RFLP. En ningún sujeto se observó la mutación por lo que se concluyó que la misma no tendría valor patogénico, al menos entre la población taiwanesa27.
• Hager et al estudiaron la población francesa y de Cerdeña con diabetes no insulinodependiente; hallaron que la mutación en cuestión se encuentra en una proporción estadísticamente significativa (chi2 =14.4; p= 0.0001)28.
También se ha pretendido establecer una relación entre las complicaciones diabéticas y la carga genética. Por ejemplo, se observó una mayor susceptibilidad para la nefropatía diabética entre los indios Pima29.
Otro estudio demostró una mayor frecuencia de retinopatía diabética en pacientes negros con DMNID respecto de la población blanca (50% vs 19%), esta diferencia no pudo ser atribuida a factores ambientales por lo que se concluyó que tendría relación con factores genéticos30. El síndrome metabólico del hipertenso también se relacionó con factores genéticos observándose especialmente entre las mujeres de la población venezolana de origen hispano31.
En nuestro estudio, como hicimos notar en los resultados, el 58% de los pacientes presentaron complicaciones, siendo la más frecuente de ellas la retinopatía y en segundo lugar la macroangiopatía a predominio arteriopático. Sin embargo, no pudimos demostrar una relación entre las complicaciones halladas y la carga genética.
Asimismo, la investigación que llevamos a cabo mostró la presencia de la mutación en dos sujetos con la enfermedad mientras que no fue observada en ninguno de los controles. Cabe consignar que esta diferencia es significativa estadísticamente (p < 0,05). Es posible que el tamaño de la muestra impresione como "pequeño". Al respecto, es importante recordar que no existe un tamaño ideal de la muestra y que sólo se puede afirmar que la misma es insuficiente cuando no se hallan diferencias estadísticamente significativas entre la muestra problema y la muestra control. En dicho caso, sí se debe incrementar el número de sujetos de acuerdo a un cálculo estadístico especial y en función del error beta aceptado. Por el contrario, cuando se encuentran diferencias, como en este aspecto de nuestra investigación, aunque el número de sujetos sea de, por ejemplo, diez o quince, no sólo carece de sentido incrementar el tamaño sino que, además, resulta antieconómico desde el punto de vista metodológico32.
Queremos también destacar que el método bioquímico utilizado permite la detección de mutaciones puntuales así como pequeñas inserciones o deleciones por lo que puede ser aplicado satisfactoriamente en grandes poblaciones con fines de tamizado (screening).
Uno de los casos con la mutación padecía diabetes conocida con dos meses de antigüedad, no tenía complicaciones y recibía dieta hipoglucémica más antidiabéticos orales como tratamiento. Tenía 43 años, padre y hermano diabéticos y pertenecía al grupo étnico de los comechingones. El otro paciente, de 55 años, con una antigüedad conocida de su diabetes de cuatro años y con madre diabética, padecía retinopatía como complicación. Recibía dieta junto a antidiabéticos orales y pertenecía al grupo guaraní.
Como podemos apreciar, a diferencia de la mayor parte de la literatura consultada, nuestro trabajo evidencia una alteración genética (mutación Gly 40 Ser) en los pacientes con DMNID, en nuestro caso pertenecientes a población no caucásica del noroeste de Argentina, Paraguay, Bolivia y Perú. Desconocemos el papel que esta mutación jugaría en la fisiopatología de la enfermedad en esta
población. No obstante, queremos enfatizar que la DMNID (como la mayoría de las enfermedades poligénicas) son el resultado de una interrelación entre factores ambientales y genéticos. Estos últimos no son determinantes sino que tan sólo ofrecen un terreno con mayor predisposición para el desarrollo del padecimiento. Insistimos en la necesidad de no caer en un reduccionismo que puede resultar muy tentador a la hora de dar una explicación etiológica o de avisorar una terapia génica que ofrezca una solución definitiva. La importancia que, sin duda, tienen los genes no debe opacar las múltiples variables intervinientes en la patogenia de cualquier enfermedad poligénica.
Conclusiones
En base a los resultados de nuestra investigación y a la bibliografía consultada hemos llegado a las siguientes conclusiones:
1. La DM es una enfermedad de prevalencia significativa (7% de la población).
2. En su etiopatogenia intervienen tanto factores predisponentes, presumiblemente genéticos, como factores ambientales.
3. Si bien la predisposición genética parece ser importante, no existen evidencias de un nexo causa – efecto necesario.
4. La DM tipo II, en su aspecto genético, es considerada una enfermedad poligénica.
5. La explicación genética de la DM tiene no sólo un interés académico sino también tecnológico pues vislumbra la posibilidad de una terapia génica de la enfermedad.
6. Se han establecido correlaciones entre una determinada mutación genética y la población diabética perteneciente a ciertos grupos étnicos.
7. La mutación Gly 40 Ser en el gen que codifica para el receptor del glucagón fue hallada entre la población diabética de Francia y Cerdeña.
8. Se desconoce el papel exacto que esta mutación jugaría en la patogenia de la enfermedad.
9. La misma mutación fue estudiada en otros grupos poblacionales no hallándose entre los diabéticos.
10. La mutación Gly 40 Ser fue observada de manera estadísticamente significativa (p< 0.05) en los pacientes diabéticos de población no caucásica del noroeste Argentino, Bolivia, Paraguay y Perú.
11. El método bioquímico utilizado permite la detección de mutaciones puntuales así como pequeñas inserciones o deleciones por lo que puede ser aplicado satisfactoriamente en grandes poblaciones con fines de tamizado (screening).
12. El 58% de los pacientes estudiados presentaba complicaciones diabéticas siendo las más frecuentes la retinopatía y la arteriopatía periférica.
13. Algunos estudios muestran una relación entre la carga genética y el tipo de complicación, relación no evidenciada por nosotros.
BIBLIOGRAFIA
1-Fujisawa, T. The genetics of NIDDM diabetes. Clinical Rewiews, 1996, vol. 8, n° 3, p 11.
2- Ghosh, S; Schork, NJ. Perspectives in diabetes. Genetic analisys of NIDDM. The study of Quantitative traits. Diabetes 45:17 14, 1996.
3- Lillioja, S; Mott, DM; Spraul, M; Ferraro, R; Foley, JE; Ravussin, E; Knowler, WC; Bennet, PH; Bogardus, C. Insulin resistance and insulin secretory dysfuntion as precursors of noninsulindependent diabetes mellitus. N Engl J Med 329;1988-1992,1993.
4- Turner, R; Hattersley, A; Shaw, J; Levy, J. Type II Diabetes: Clinical aspects of Molecular Biological Studies. Diabetes, vol 44,January 1995.
5- Velho, G; Froguel, P. The genetic determinant of NIDDM:Strategies and results. Diabetes and Metabolism 23:7-17,1997. Cf. Tb. Shaid DJ, Sommer SS. Comparation of stadistcs for candidate gene association studies using cases and patients. Am J Hum Gent, 55:402-409, 1994.
6- Moller, D; Bjorbe, KC; Vidal Puig, A. Candidate genes for Insulin Resistance. Diabetes Care,19, number 4, April 1996. Cf. Tb. Mitchell, BD; Kammerer, CM; Hixson, JE; Atwood, LD; Hakelman, S; Blangero, J; Haffner, SM; Stren, MP; Mc Cluer, JW. Evidence for a major gene afecting inulin levels. Burcelin,R;Katz,E;Charron,M.Molecular and cellular aspects of the Glucagon receptor:Role in Diabetes and Metabolism. Diabetes & Metabolism. 1996,22,373-396.
7- Unson, C; Cypess, A; Kim, H; Goldschmidt, P; Carruthers, C; Merrifiel, R; Sakmar,T. Characterization of deletion and truncation mutants of the rat glucagon receptor.Seven transmembrane segments are necessary for receptor transport to the plasma membrane and glucagon binding. J Biol Chem,1995 Nov 17,270:46,27720-7.
8- Memzel, S; Stoffe,M; Espinosa, R; Fernald,A; Lebeau,M; Bell, G. Locali zation of the glucagon receptor gene to human chromosome band 17q25. Genomics 20:327-328,1994.
9- Grant, F; Biggs, S; Rosemberg, G; Sheppard, P; O' Hara, P; Foster, D; Kindsvogel, W. The human glucagon receptor encoding gene:structure, cDNA sequence and chromosomal localizatíon. Gene 140:203-209,1994. Cf. Tb. Abrahamsen, N; ; Nishimura, E. Regulation of glucagon and glucagon-like peptide-1 receptor mRNA expression in cultured rat pancreatic islets by glucose, cAMP and glucocortícoids. Endocrinology 136:1572:1578. 1995.
10- Memzel, S; Stoffe,M; Espinosa, R; Fernald, A; Lebeau, M; Bell, G. Localization of the glucagon receptor gene to human chromosome band 17q25. Genomics 20:327-328,1994.
11- Hager, J; Hansen, L; Vaisse, C; Vionnet, N et al. A missense mutation in the glucagon receptor gene is associated with non insulin dependent diabetes mellitus. Nature Genetics 9:1995.
12- Hansen, L; Abrahamsen, N; Hager, J et al. The Gly4OSer mutation in the human glucagon receptor gene associated with NIDDM results in a receptor with reduced sensitivíty to glucagon. Diabetes:45 : 725- 30, 1996.
13- Tonolo, G; Melis, M; Ciccarese, M; Secchi, G; Atzeni, M; Maioli, M; Pala, G; Massidda, A. Physiological and genetic characterization of the Gly4OSer mutation in the glucagon receptor gene in the Sardinian population. Diabetologia. 40:89-94,1997.
14- Gough,S; Saker,P; Pritchard,L; Merriman,T; Merriman,M; Rowe,B; Kumar,S; Aitman,T; Barnett,A; Turner,R; Stodd,J. Mutation of the glucagon receptor gene and diabetes mellitus in the UK: association or founder effect? Hum.Mol.Genetics 4:1609-1612,1995.
15- Cf. Birdsell, J. B. Evolución Humana. Una Introducción a la Nueva Antropología Física (Compañía Editorial Continental S. A. de C. V. México, 1986).
16- Cf. Barth, F. Ethnic groups and boundaries. The social organization of culture difference (George Allen and Unwin. London, 1969)
17- Vaag,A. On the pathophysiology of late onset non-insulin dependent diabetes mellitus.Current controversies and new insights. Dan Med Bull, Jun 1999, 46 (3), p197-234.
18- Lebovitz, HE. Type 2 diabetes: an overview. Clin Chem, Aug 1999, 45 (8 Pt 2),p1339-45.
19- Levine, F; Leibowitz, G. Towards gene therapy of diabetes mellitus. Mol Med Today, Apr 1999, 5(4), p165-71.
20- Okamoto, H. Cyclic ADP-ribose-mediated insulin secretion and Reg, regenerating gene. J Mol Med, Jan 1999,77 (1), p74-8.
21- Falqui, L; Martinenghi, S; Berra, C; Monti, L; Leone, BE; Pozza, G; Bordignon, C. Human proinsulin production in primary rat hepatocytes after retroviral vector gene transfer. J Mol Med,Jan 1999, 77(1), p250-3.
22- Fujisawa, T. y col. A mutation in the glucagon receptor gene (Gly 40 Ser): heterogeneity in the association with diabete mellitus. Diabetologia, 1995, 38: 983 – 985.
23- Odawara, M y col. Gly 40 Ser substitution in the glucagon receptor is rarely involved in the pathogenesis of NIDDM in japanese patients. Diabetes Care,1996, vol. 19, n ° 5, p 547.
24- Tonolo, G. y col. Physiological and genetic characterization of Gly 40 Ser mutation in the glucagon receptor gene in the Sardinian population. Diabetologia, 1997, 40 : 89 – 94.
25- Hart, L.M. y col. Absence of the Gly 40 Ser mutation in the glucagon receptor among diabetic patients in the Netherlands. Diabetes Care, 1995, vol. 18, n° 10, pp 1400 – 01.
26- Huang, X. y col. Lack of association between the Gly 40 Ser polymorphism in the glucagon receptor gene and NIDDM in Finland. Diabetologia, 1995, 38: 1246 – 48.
27- Huang, CN y col. Screening for the Gly 40 Ser mutation in the glucagon receptor gene among patients with type 2 diabetes or essential hypertension in Taiwan. Pancreas, 1999, 18 (2), pp 151 – 55.
28- Hager, J; Hansen, L; Vaisse, C; Vionnet, N et al. A missense mutation in the glucagon receptor gene is associated with non insulin dependent diabetes mellitus. Nature Genetics 9:1995.
29- Fagerudd, JA y col. The impact of a family history of Type II diabetes mellitus on the risk of diabetic nephropathy in patients with Type I diabetes mellitus. Diabetologia, 1999, 42 (5), pp 519 –26.
30- Harris, EL y col. Black – white differences in risk of developing retinopathy among individuals with type 2 diabetes. Diabetes Care, 1999, 22 (5), pp 779 – 83.
31- Florez, H y col. Women relatives od Hispanic patients with type 2 diabetes are more prone to exhibit metabolic disturbances. Invest Clin, 1999, 40 (2), pp 127 – 42.
32- Cf. Dawson – Saunders, B. y col.. Bioestadística Médica (México, El Manual Modernos, 1993), pp 111 – 113.
|

