Tratamiento
farmacológico estándar del infarto agudo de miocardio
Dra. Valerioti Maria Jorgelina
INTRODUCCIÓN
Cada año 1,5 millones de personas son diagnosticadas
de infarto agudo de miocardio (IAM). La
mortalidad ha disminuido de 12% a 6-7% a causa de la
terapéutica con aspirina (AAS) y la reperfusión
temprana con trombolíticos o angioplastia.
En Argentina hay aproximadamente 40.000 IAM
por año. El 40% no es diagnosticado por carecer
de sintomatología. El 5% de este 40% es enviado
a su domicilio sin estudio de ningún tipo con los
riesgos que ello implica.
En la actualidad, los criterios de patología coronaria
aguda se basan en la elevación (síndrome con
elevación ST que corresponde a la vieja clasificación
del infarto Q) o no elevación del segmento ST
(síndrome sin elevación del ST que corresponde a la
vieja clasificación del infarto no Q). La
importancia la marca el beneficio que los pacientes
con elevación del ST tienen al administrarles en las
primeras seis horas trombolisis o angioplastia
coronaria transluminal percutánea (ACTP).
El Colegio Americano de Cardiología recomienda
al médico de atención primaria que el primer
objetivo sea determinar en los primeros 20 minutos
si el paciente tiene IAM y si es candidato para
reperfusión.
Operativamente es importante estratificarlo para
saber si requiere de tratamiento invasivo con revascularización
o no es necesario tratamiento quirúrgico;
utilizando como parámetros: la extensión de la
enfermedad coronaria, el grado de isquemia y la
función ventricular.
El paciente con el diagnóstico IAM debe ser
derivado a Unidad Coronaria (U.C.O) de urgencia
y mientras se aguarda la derivación debe
instaurarse el tratamiento adecuado (que calme el
dolor, que lo tranquilice y evite complicaciones) ya
sea farmacológico o de reperfusión. Acontinuación se
describirá el tratamiento farmacológico standard
para el manejo del IAM.
TERAPIA ANTIPLAQUETARIA
Debido a que la agregación plaquetaria y
formación del trombo son las causas más
próximas al síndrome coronario agudo, tanto las
plaquetas como los agentes antitrombóticos han sido
extensamente investigados para el tratamiento y
prevención de estos síndromes. El ácido
acetilsalicílico (aspirina),el agente antiplaquetario
mejor estudiado, acetila irreversiblemente la
ciclooxigenasa y por lo tanto inhibe la producción
del tromboxano A2 (un potente vasoconstrictor y
estimulador de la agregación plaquetaria) por parte
de las células. La aspirina también inhibe la
producción de prostaciclina por parte del endotelio,
un potente vasodilatador. El efecto en las plaquetas
es irreversible, mientras en el endotelio es
transitorio, debido a la posibilidad de las células
endoteliales de resintetizar ciclooxigenasa.
Se han utilizado dosis entre 75 mg y 1.500
mg diarias, pero las altas dosis de aspirina se
asociaron a un alto riesgo de efectos adversos y
mayor inhibición de la prostaciclina endotelial.
En los síndromes coronarios agudos, una dosis de
carga de 160-325 mg masticada, produce una
rápida inhibición plaquetaria. Además, su uso en el
IAM, está asociado con una disminución de la tasa de
mortalidad, así como también de las tasas de
reinfarto no fatal y ACV no fatal.
En pacientes con antecedentes de intolerancia o
alergia a aspirina puede utilizarse clopidogrel
(derivado de la ticlopidina pero sin los efectos
adversos de ésta) por vía oral en dosis de ataque 4
comprimidos de 75 mg. Administrar aspirina
como primera medida es una recomendación Clase I,
basada en la evidencia tipo A. fibrilación auricular
con insuficiencia cardíaca congestiva, embolia
previa.
Papel de la aspirina para el tratamiento del IAM

TERAPIA ANTITROMBÓTICA
Papel de la heparina en el tratamiento del IAM
El efecto antitrombótico de la heparina está
mediado a través de la antitrombina III; el
complejo heparina-antitrombina III inhibe la
polimerización de la fibrina mediada por la trombina
(factor la). También inhibe los factores pro
coagulantes IXa, Xa, XIa y XIIa.
Las heparinas de alto peso molecular tienen baja
afinidad por antitrombina III pero pueden
prolongar el tiempo de sangrado a través de un
efecto antiplaquetario. Las fracciones de bajo peso
molecular ejercen un fuerte efecto anticoagulante a
través de la inhibición preferencial del factor Xa.
En pacientes con IAM, la anticoagulación sistémica
con heparina se utiliza para mejorar la
permeabilidad de las arterias relacionadas con el
infarto y limitar el tamaño de éste. También
proporciona profilaxis contra la formación de
trombos murales ventriculares.
La heparina debe ser administrada en ciertas
situaciones clínicas específicas, tales como un
trombo ventricular izquierdo, fibrilación auricular
con insuficiencia cardíaca congestiva, isquemia
recurrente, trombosis venosa profunda, o la
prevención de la misma, en los pacientes en cama con
reposo prolongado (para ello se justifica la
utilización de heparinas subcutáneas).
Esquema de anticoagulación con heparina
Se consideran factores de riesgo para desarrollar
embolia sistémica durante IAM a: IAM anterior,
Pacientes con trombolisis
Anticoagulación con heparina por 48hs.
Luego profilaxis con heparina hasta deambulación.
Ácido acetil salicílico permanente.
Pacientes con trombolisis y factores de riesgo
Anticoagulación con heparina por 48-
72hs. Luego pasaje a dicumarínicos por 3 meses.
Ácido acetil salicílico permanente.
Pacientes sin trombolisis y factores de riesgo
Igual al anterior
Si el paciente no tolera aspirina se puede
utilizar clopidogrel 75 mg.
Pacientes sin trombolisis y sin factores de riesgo
Profilaxis con heparina hasta deambulación.
Ácido acetil salicílico permanente.
Dosis de la anticoagulación con heparina
Heparina no fraccionada:
Bolo I.V. 80 U/Kg
Mantenimiento 18 U/Kg/hora
Heparina bajo peso molecular: -Vía S.C.
1mg/Kg cada 12 hs.
Dosis de la profilaxis con heparina
Heparina no fraccionada: Vía S.C. 5000
U cada 8 ó 12 hs.
Heparina bajo peso molecular: Vía S.C.
40 mg cada 24 hs.
En pacientes con infarto agudo de miocardio, el
rango de accidente cerebrovascular embólico a los
5 años es del orden de 8,1% (además de episodios
de TEP y embolia periférica). Contradiciendo
estudios previos, se ha observado que la
posibilidad: de ACV embólico aumenta mas allá de los
6 meses post-IAM. Como factores de riesgo
independientes, se han observado dos factores
principales, la edad avanzada (mayor de 60 años), y
la fracción de eyección igual o menor a 28% (este
indicador es más sensible que otras determinaciones
utilizadas en trabajos anteriores: presencia de
corazón grande en las radiografías, o fracción de
acortamiento baja en el ecocardiograma).
También debe tenerse en cuenta que por
debajo de 40% en fracción de eyección, cada 5%
de disminución, se produce un 18% de aumento
en la incidencia de ACV embólico. La aspirina y los
anticoagulantes disminuyen significativamente estos
riesgos.
TRATAMIENTO CON BETABLOQUEANTES (BB)
El efecto inotrópico negativo de bloqueo del
receptor beta 1 adrenérgico, puede reducir el
estrés parietal y la demanda miocárdica de oxígeno.
La asociación de efectos cronotrópicos negativos
puede prolongar el tiempo diastólico para la
perfusión coronaria, mejorando el aporte de sangre a
aquellas zonas mal irrigadas debido a enfermedad
coronaria severa. Los BB pueden equilibrar el
balance entre el sistema nervioso simpático y
parasimpático, lo que podría reducir la tendencia
hacia el desarrollo de arritmias amenazantes en
pacientes con enfermedad isquémica cardíaca.
Los BB deberían ser un componente integral en el
manejo médico estándar del IAM. Los BB
administrados precozmente en el curso del IAM se
asocian con reducciones significativas de la
morbilidad y la mortalidad. Estos beneficios
persisten en pacientes mantenidos crónicamente con
BB.
En aquellos que reciben trombolisis, la adición de
un BB puede reducir la incidencia de reinfarto.
A pesar de la potencialidad de efectos adversos de
dicha terapia en ciertos subgrupos de riesgo en
pacientes con IAM (edad avanzada, ICC
manifiesta, hipotensión transitoria, gran IM o
complicaciones arrítmicas) los datos obtenidos
muestran que precisamente son éstos los pacientes
que más se benefician con ellos.
La evidencia de la utilidad de los ß-bloqueantes
intravenosos en la fase aguda del infarto está
basada en grandes estudios randomizados en la
era pre-trombolítica y en consensos sobre
conservación de este beneficio en la era actual.
Una limitación de su aplicación masiva ha sido el
prejuicio equivocado sobre sus riesgos, que aún
persiste en parte con la consiguiente pérdida de
vidas y complicaciones evitables.
INHIBIDORES DE LA ENZIMA CONVERTIDORA
DE LA ANGIOTENSINA (IECA)
Para pacientes que sufren un IAM, el tratamiento
con un IECA añadido a la terapia convencional se
asoció con un modesto pero significativo efecto
sobre la reducción de la mortalidad a corto y largo
plazo, así como en la incidencia de progresión
hacia el desarrollo del fallo de bomba.
Los beneficios observados en la mortalidad con
los IECA fueron congruentes entre todos los
subgrupos analizados y especialmente importantes en
los ancianos y pacientes con disfunción del VI
severa.
En general, los IECA pueden ser administrados de
manera segura dentro de las 24 horas de inicio del
IAM. Aunque los pacientes tienden a incrementar
la hipotensión que limita el tratamiento, este
efecto no tuvo repercusión en un aumento de
mortalidad.
Efectos de los inhibidores de la enzima convertidora sobre
la mortalidad en diferentes subgrupos.
Se debe considerar el uso de rutina de un
inhibidor de la ECA luego de un IM para todos lo
pacientes, pero especialmente para aquéllos con
infartos grandes y función ventricular izquierda
reducida, con o sin ICC franca. El tratamiento
precoz parece beneficioso, y la institución de un
inhibidor de la ECA debe comenzar cuando se
juzgue hemodinámicamente seguro. La duración del
tratamiento se debe extender hasta por lo menos 6
semanas, momento en el cual se debe revisar la
indicación de la utilización a un plazo más largo
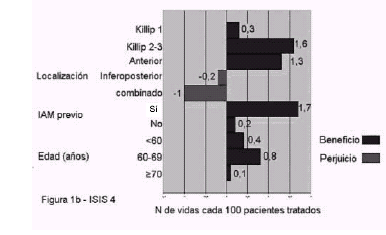
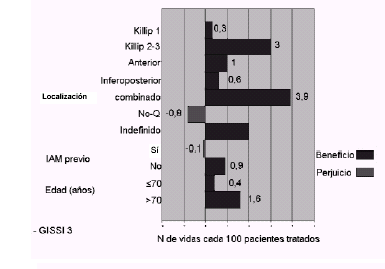
(ICC, fracción de eyección baja). Estudios GISSI 3 (Lisinopril)
e ISIS 4 (captotril) 1a (GISSI 3) y 1b (ISIS 4):
efecto de acuerdo al Killip de ingreso, localización
del infarto, infarto previo y edad. Se observa que
el número de vidas salvadas es 5 a 10 veces mayor en
pacientes con insuficiencia cardíaca (Killip >1) y
es más notable en los infartos anteriores, sin
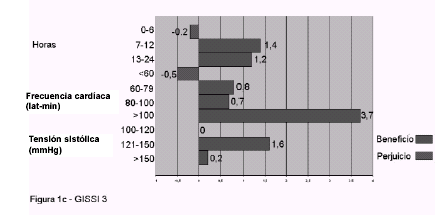
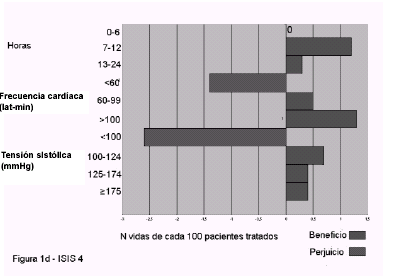
relación clara con infarto previo o edad. 1c (GISS
4) y 1d (ISIS 4): efecto de acuerdo a horas de
evolución, frecuencia cardíaca y tensión arterial
sistólica. El número de vidas salvadas cada 100
pacientes no se relaciona con su utilización precoz,
es mayor en pacientes con frecuencia cardíaca baja y
presión arterial normal, y puede no ser útil o
incluso perjudicial si la tensión sistólica es menor
de 100 mmHg.
TERAPÉUTICA CON NITRATOS
La nitroglicerina (NTG) es fundamentalmente
una droga venodilatadora, mientras el
nitroprusiato de sodio tiene ambos efectos
(vasodilatador arterial y venoso). Aunque
ambos agentes pueden reducir la precarga del
VI, la NTG teóricamente tiene la ventaja de que
aumenta el flujo sanguíneo regional miocárdico del
tejido isquémico. El nitroprusiato puede
desviar el flujo coronario desde zonas isquémicas a
otras bien prefundidas (efecto de robo).
La nitroglicerina puede recomendarse para la fase
aguda del infarto en la medida en que el paciente
persista con signos de isquemia (angor y/o
elevación del segmento ST), con hipertensión
arterial y/o con signos de insuficiencia cardíaca.
Debe titularse la dosis en forma creciente hasta
normalizar los síntomas, evitando que la presión
sistólica se reduzca más del 10%, o llevarla a
niveles normales si estaba elevada antes de
iniciada la infusión. Ésta debería mantenerse, como
rutina, durante 24 a 48 horas, o por períodos más
prolongados ante la persistencia de insuficiencia
cardíaca o recurrencia anginosa.
El uso de NTG I.V. como complemento a los IECA
mostró reducción en la mortalidad postinfarto.
No existen datos a favor del uso crónico de
nitratos en pacientes sin isquemia activa en el
período post-infarto.
TERAPÉUTICA CON
CALCIOANTAGONISTAS
Los calcioantagonistas son un grupo diverso de
drogas con efectos variables sobre el tono
vasomotor, la contractilidad del VI, y el
automatismo de las células "marcapasos" del corazón.
El principal efecto del verapamil es el inotropismo
y cronotropismo negativos, sin propiedades
vasodilatadoras significativas. El diltiazem posee
un efecto vasodilatador periférico adicional, y el
nifedipino provoca una relajación del tono vasomotor
y taquicardia refleja. A pesar de numerosas razones
teóricas por las que estos fármacos deberían de ser
capaces de limitar el tamaño del infarto, mejorar la
clínica, reducir la mortalidad, etc., los resultados
de los estudios con los agentes de primera
generación (nifedipino, verapamil, diltiazem) han
sido desalentadores. Sin embargo, las
dihidropiridinas de segunda generación tales como el
amlodipino, las cuales exhiben un menor efecto
inotrópico negativo y que son más potentes y
selectivas en términos de vasodilatación, podrían
tener algún beneficio en el alivio de los síntomas y
mejoría de la supervivencia después del IAM.
En resumen, los resultados de estudios randomizados
hasta la fecha no aconsejan el uso de calcioantagonistas
en el tratamiento rutinario de pacientes postinfartados.
Además, se deberían usar con precaución como antiisquémicos
o antihipertensivos, en pacientes con
intolerancia a los BB.
MAGNESIO
Este ión se consideró como un antagonista fisiológico
de los canales de calcio, que producía vasodilatación
coronaria y sistémica, inhibiría la agregación
plaquetaria y suprimiría ectopía ventricular.
Estudios realizados sostienen que altas dosis de
magnesio pueden asociarse a mayor riesgo de muerte
en pacientes hemodinámicamente inestables, así pues,
este tratamiento no se sugiere en el manejo de estos
pacientes.
Si bien se han reunido varias críticas contra muchos de
los estudios previos, actualmente no se recomienda el
uso de rutina del magnesio intravenoso. Pueden
beneficiarse aquellos pacientes con hipomagnesemia
sospechada o documentada, particularmente aquéllos
con arritmias ventriculares.
PAPEL DE LA TERAPÉUTICA EMPÍRICA ANTIARRÍTMICA
EN EL TRATAMIENTO DEL IAM
La presencia de complejos ventriculares
prematuros (EV) después del IAM, es un
marcador de riesgo que señala una subpoblación con
mortalidad aumentada. Por esta razón, ha habido
mucho entusiasmo en el uso de drogas antiarrítmicas
para la supresión de dichos complejos, tanto en
pacientes sintomáticos como no sintomáticos; con
propósitos de discusión, los estudios que evaluaron
el papel de los antiarrítmicos empíricos para la
supresión de los EV en el momento agudo del IM (por
ejemplo con lidocaína i.v.) los separaremos de
aquellos que evaluaron el papel de esta droga para
la supresión de los EV a largo plazo, fuera del
momento agudo (con agentes orales tales como
encainida, flecainida y amiodarona).
Terapia empírica en el momento agudo del IAM
Catorce estudios PRCT que recogieron un total de
8.000 pacientes compararon el uso rutinario de
lidocaína profiláctica frente a placebo en pacientes
con sospecha de IAM.
Si los datos de los 14 estudios se agrupan, la
lidocaína disminuyó el riesgo de FV pero no la
mortalidad. De hecho hubo una tendencia no
significativa hacia una mayor mortalidad con
lidocaína. Si los datos conjuntos se limitan sólo a
los 8 estudios que utilizaron lidocaína i.v., ésta no
tuvo efecto en el riesgo de FV pero incrementó el
riesgo de muerte.
Papel del uso profiláctico i.v o i.m. de lidocaína para el IAM


Una alternativa al uso profiláctico de rutina de
lalidocaína es la de limitarla a aquellos pacientes
que experimenten EV en el momento posterior al
infarto.
Un problema con esta estrategia es que cerca del
50% de la FV primaria ocurre sin avisar (por
ejemplo, EV previa). Sin embargo, el uso selectivo
de la lidocaína no parece asociarse a un peor
resultado en cuanto a mortalidad en relación con el
uso profiláctico. Por ejemplo, en un estudio, no
hubo diferencias significativas en la mortalidad o
el riesgo de taquicardia ventricular o FV entre las
dos estrategias. De hecho, hubo una tendencia hacia
el riesgo mayor de toxicidad con la estrategia
profiláctica de rutina, especialmente para los
pacientes mayores.
La lidocaína es efectiva para prevenir fibrilación
ventricular, pero su uso sistemático se asocia con
un incremento de la mortalidad. Parece lógico
restringir su indicación a pacientes con arritmias
muy complejas premonitorias de fibrilación
ventricular durante la fase aguda o luego de su
resucitación en la unidad coronaria, con dosis
efectivas de 3 a 4 mg/minuto, después de un bolo
inicial de 1 a 2 mg/Kg.
Terapia empírica para la supresión a largo plazo
Como se indicó previamente, los pacientes
postinfartados con EV tienen mayor riesgo de
muerte. Por ello, multitud de antiarrítmicos se
estudiaron en un intento de suprimir los EV
sintomáticos de estos pacientes.
En resumen, los datos aportados hasta la fecha no
apoyan el tratamiento de rutina de lidocaína
profiláctica para la supresión de las arritmias
asintomáticas ventriculares en el momento agudo del
IM. Para los pacientes postinfarto, pasada la fase
aguda, los agentes clase I (encainida, flecainida y
oriczina) parecen incrementar la mortalidad y por lo
tanto deberían ser evitados.
Los estudios con amiodarona en pacientes con
IAM han comunicado resultados ambiguos,
parece ser el menos peligroso de los agentes
disponibles y debe ser considerado cuando esté
indicado el control de una arritmia específica,
mucho más allá de lo que pueda efectuar el ßbloqueo
solo.
TERAPÉUTICA HIPOLIPEMIANTE
La aterosclerosis ha sido considerada como un
proceso irreversible y progresivo, susceptible sólo
de terapia revascularizadora. Estudios más
recientes han demostrado que el tratamiento médico
con agentes hipolipemiantes puede detener la
progresión e incluso regresar la enfermedad
aterosclerótica.
Las placas más pequeñas son más frecuentemente
responsables de infartos agudos que las placas
estenóticas.
La terapéutica hipolipemiante debería ser un
componente integral de la terapia standard para la
prevención primaria y secundaria de la morbimortalidad
cardiovascular en pacientes con niveles de
colesterol elevados. Dicha terapia puede tener la
progresión y promover regresión de la enfermedad
aterosclerótica establecida.
Los pacientes con IAM deberían tener un perfil
lipídico completo tan pronto como ingresen. Si los
niveles de LDL colesterol son mayores de 160
mg%, el paciente debería ser dado de alta con
medicación hipolipemiante, porque la dieta sola es
normalmente insuficiente para lograr el nivel
deseado de menos de 100 mg%, o de 25% a 35% de
reducción del nivel basal de LDL. Para los pacientes
con un nivel de colesterol LDL menor de 130 mg %,
las modificaciones de la dieta y el ejercicio pueden
ser suficientes. Una repetición del análisis
sanguíneo debe obtenerse de semanas a meses después
del alta, debido a que los niveles de ingreso
podrían estar falsamente disminuidos.
Se realizaron estudios que demostraron una
reducción del 30% en las muertes totales y del
42% en la mortalidad coronaria en pacientes
tratados con simvastatin por colesterol elevado.
Similares resultados se observaron en pacientes
tratados con pravastatin.
Papel del uso profiláctico frente a selectivo de lidocaína
para el IAM

ABSTINENCIA TABÁQUICA
La exposición al tabaco produce daño arterial
difuso e incrementa el riesgo de IAM promoviendo
la vasoconstricción, favoreciendo la agregación
plaquetaria e incrementando la oxidación de
las lipoproteínas. Por tanto, a todos los fumadores
activos debería recomendársele el abandono del
tabaco.
TERAPIA DE SUSTITUCIÓN ESTROGÉNICA PARA
LA PREVENCIÓN DE EC EN MUJERES
El riesgo de IAM se incrementa significativamente
en mujeres después de la menopausia, alcanzando
rápidamente un nivel comparable a aquél en la
población masculina correspondiente. Los estrógenos
poseen multitud de efectos biológicos que hacen
decrecer el riesgo de aterosclerosis coronaria.
Ello incluye el aumento de las lipoproteínas HDL, la
disminución de los niveles de fibrinógeno, la
disminución de la presión arterial y el aumento de la
vasodilatación periférica. Los estrógenos pueden
afectar el metabolismo de los carbohidratos al
aumentar la sensibilidad a la insulina.
La terapia sustitutiva estrogénica debería considerarse
en todas aquellas mujeres posmenopáusicas,
con insuficiencia ovárica precoz, u ovariectomizadas,
especialmente si tienen factores de riesgo
conocidos para EC o historia previa de IAM.
La adición de progesterona es apropiada en mujeres
que todavía tienen útero para reducir los riesgos de
la terapia estrogénica sin contraposición.
INTERVENCIÓN METABÓLICA: GLUCOSA
- INSULINA - POTASIO
No existe evidencia definitiva sobre la utilidad de
la solución polarizante, pero los informes hasta
ahora son coherentemente positivos. El potencial
de esta intervención muy económica es muy
grande, porque podría transformarse en el primer
tratamiento "metabólico" útil en la fase aguda del
infarto.
TERAPÉUTICA TROMBOLÍTICA
Numerosos estudios han demostrado cómo en
pacientes con infarto agudo de miocardio, la
pronta restauración y el mantenimiento de flujo
anterógrado vigoroso en la arteria responsable del
infarto (ARI), puede limitar su tamaño, preservar la
función ventricular izquierda, atenuar el remodelado
y mejorar la supervivencia. En general, la
terapéutica trombolítica administrada en las
primeras seis horas desde el comienzo de los
síntomas, se asocia con un 25% de reducción en la
mortalidad.
Esta terapéutica está al alcance de la mayoría de
los centros de atención por lo que continúa siendo
el primer tratamiento elegido para aquellos
pacientes con IAM; a diferencia de la angioplastia
(procedimiento invasivo de revascularización) donde
los requerimientos para poder llevarla a cabo
limitan la disponibilidad de la misma a centros de
atención muy especializada.
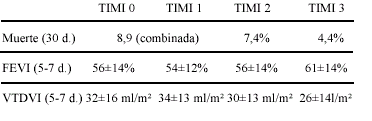
Los pacientes con flujo coronario normal (TIMI
grado 3, de una escala de 0 a 3) a los 90 minutos
después de iniciar la terapéutica trombolítica
tuvieron la mayor preservación de función
ventricular izquierda (FEVI) y movimiento regional
segmentario, comparado con los pacientes que tenían
oclusión persistente o la ARI casi ocluida (flujo
TIMI grado 0 ó 1, respectivamente). Además, el
índice de volumen telediastólico del ventrículo
izquierdo (VTDVI), reflejo del tamaño del infarto y
el remodelado, era significativamente más bajo en
pacientes con flujo TIMI grado 3 a los 90 minutos,
comparados con aquéllos con flujos 0, 1 o 2 .
La presencia de un flujo anterógrado vigoroso
(TIMI 3) a los 90 minutos se asoció con una
mortalidad a los 30 días significativamente menor,
comparada con las arterias persistentes ocluidas a
pesar del agente trombolítico usado.
CRITERIOS PARA ADMINISTRACIÓN DE LA
FIBRINOLISIS
Indicaciones de Trombolisis
Se deben indicar trombolíticos por vía intravenosa
a todo paciente con sospecha o evidencia de IAM
que presente supradesnivel del segmento ST en
dos o más derivaciones y se encuentre evolucionando
dentro de las primeras 12 horas desde el comienzo
del cuadro. Luego de las 12 horas no existe una
indicación absoluta, pero la presencia de angor y de
supradesnivel de ST pueden ser los motivos lógicos
para iniciar el tratamiento.
Daños
Los trombolíticos pueden inducir diferentes
efectos adversos (hipotensión arterial, reacciones
de hipersensibilidad, etc.), pero los más frecuentes
y riesgosos son las hemorragias y el enigmático
riesgo temprano ("early hazard").
Accidente cerebrovascular: la incidencia se
incrementa en 4 pacientes cada 1.000 tratados a
expensas del ACV hemorrágico.
Hemorragia: con el empleo de trombolíticos
existe un riesgo mayor de hemorragia con
necesidad de transfusión de dos o más unidades.
Como causa más frecuente: hemorragia digestiva.
Riesgo temprano ("early hazard"): un metaanálisis
mostró que en días 0-1 la mortalidad de los
pacientes tratados con trombolisis fue mayor que la
del grupo control (648 muertes frente a 526).
Después del día 2, la tendencia fue inversa y se
consolidó el efecto beneficio de los trombolíticos.
Contraindicaciones absolutas y relativas para
la trombolisis Un incremento del riesgo de
sangrado es el principal efecto adverso asociado con
la terapia trombolítica. Algunos riesgos de sangrado
se han agrupado bajo el término de
<<contraindicaciones relativas>>, reflejando la
necesidad de sopesar los riesgos modestos frente a
los beneficios sustanciales. Por contra, las
contraindicaciones absolutas para la fibrinolisis
denotan condiciones asociadas a alto riesgo de
morbimortalidad debida al sangrado. Si existe
posibilidad de revascularización mecánica, entonces
la presencia de numerosas contraindicaciones
relativas puede hacer de la angioplastia primaria
una opción atractiva. De forma alternativa, la
terapéutica trombolítica en el contexto de
contraindicaciones relativas es aceptable si el
tiempo que se fuera a perder en el transporte no
resultase excesivo. La presencia de
contraindicaciones absolutas es otra indicación de
angioplastia primaria, ya que el riesgo de sangrado
es menor y más fácilmente controlable.
Traumatismos <<contusos o afiliados>>, la
cirugía mayor, los traumatismos y la biopsia de
órganos dentro de las seis últimas semanas
deberían considerarse como contraindicaciones
absolutas para la realización de la trombolisis.
Edad: Independientemente de si recibe o no
terapia fibrinolítica, la edad avanzada se asocia
con un mayor riesgo de mortalidad intrahospitalaria
después del IAM.
Hipertensión: los pacientes que presentan
hipertensión transitoria severa (tensión sistólica >
de 180 mm Hg, diastólica > 110 mm Hg) en el
contexto de un IAM, tienen una contraindicación
relativa para el uso de terapia fibrinolítica.
Shock cardiogénico: la hipotensión debida a fallo
de bomba en el momento de la presentación de los
síntomas se asocia con un riesgo muy alto de muerte.
Existe evidencia suficiente de que los pacientes
que se presentan con shock cardiogénico en el
contexto de un IAM se podrían beneficiar más con la
ACTP que con tratamiento fibrinolítico con respecto
de la supervivencia.
Riesgo de ACV: Sin tratamiento trombolítico, hay
un 0,5 % a 1% de riesgo de desarrollar ACV
hemorrágico o isquémico, dentro de los primeros
35 días siguientes a un IAM.
Permeabilidad de la ARI, tamaño del IAM y mortalidad
después de trombolisis.
El tratamiento trombolítico se asoció con un
pequeño pero significativo aumento de la incidencia
de ACV dentro de las primeras 24 horas y de
una menor incidencia entre los 2 y 35 días.
En general, en los pacientes sin factores de riesgo
conocidos que favorezcan al sangrado intracraneal,
los beneficios en cuanto a miocardio salvado
y reducción de la mortalidad cardiovascular se
imponen ventajosamente a los riesgos de ACV
hemorrágico asociados con la terapéutica
trombolítica. Una historia remota de ACV isquémico o
reciente de ACV transitorio agudo sí deberían ser
considerados como una contraindicación relativa para
recibir esta terapia. Una historia de ACV
hemorrágico o indefinido, tumor intracraneal,
neurocirugía previa o traumatismo craneoencefálico
reciente son contraindicaciones absolutas para dicho
tratamiento.
Sangrado mayor: Definido como aquél que
requiere de la transfusión o el que amenaza la
vida, aparece en 1% de los pacientes a los que se
administran fibrinolíticos. Los pacientes con
melena, marcada hematuria, o cirugía mayor reciente,
presentan una contraindicación absoluta para la
trombolisis, mientras aquéllos con sangre oculta en
heces tienen sólo una contraindicación relativa para
la misma.
La terapia trombolítica debería considerarse
contraindicada en pacientes con una diátesis
hemorrágica definida, como es el caso de los
hemofílicos.
Contraindicaciones para la terapia trombolítica

Estreptoquinasa (SK): Es un producto del
estreptococo betahemolítico del grupo C; forma
un heterodímero con el plasminógeno que es capaz
de degradar la fibrina, el fibrinógeno, y los
factores V y VIII. La hipofibrinogenemia sistémica
que sigue a la administración de SK resulta en un
estado lítico residual que dura unas 24 horas.
La hipotensión y la bradicardia pueden suceder en
al menos el 10% de los pacientes durante la
administración. La expansión con el volumen y el
cese precoz de la infusión de SK son normalmente
necesarios para lograr la estabilización hemodinámica.
La SK puede reanudarse a un ritmo
menor, o bien sustituirse por rtPA. Una exposición
previa a la estreptoquinasa puede acompañarse de
formación de anticuerpos anti- SK, lo que podría
inhibir su actividad enzimática.
Reacciones cutáneas alérgicas o incluso un shock
anafiláctico pueden suceder a la administración de
SK en pacientes sensibilizados. Por lo tanto, el
rtPa debería usarse para trombolisis sucesivas en
pacientes tratados previamente con SK.
La terapia con SK se asoció con un beneficio significativo
en la reducción de la mortalidad a 21 días.
El beneficio en supervivencia se restringió a
pacientes que se presentaron con IAM anterior y
recibieron el tratamiento dentro de las primeras 6
horas de inicio de los síntomas, y persistió hasta
después de 1 año de finalizada la terapia inicial.
El riesgo relativo de infarto en pacientes que
reciben SK fue de 1,42 comparado con el grupo
control, reflejando la reoclusión de la ARI después
de una inicialmente exitosa recanalización.
Un análisis por subgrupos sugirió que el beneficio
en la supervivencia se restringió a pacientes de
menos de 65 años, aquéllos con IAM de pared
anterior, historia previa de IAM y aquéllos en clase
Killip I a III.
El riesgo de sangrado mayor y de shock anafiláctico
fue bajo, 0,3% y 0,1% respectivamente.
La droga standard en nuestro medio es la SK, en dosis
1.500.000 unidades durante una hora de infusión.
Existe una mayor tendencia hacia el empleo SK
cuando el IAM se presente más tardíamente o cuando
exista un mayor riesgo de ACV (hipertensión arterial,
edad avanzada, etc.).
Activador tisular del plasminógeno recombinante
(rtPA): Es una proteasa endógena sérica que forma
un complejo ternario con la fibrina y el plasminógeno
y cataliza la conversión del plasminógeno a
plasmina. La eficiencia enzimática del rtPA para
actuar sobre la fibrina ligada es más alta que sobre
la fracción de la fibrina soluble, resultando de un
mayor grado de fibrinolisis tromboespecífica y un
menor grado de fibrinolisis sistémica.
Debido a que no es un antígeno extraño, la
administración de rtPA no causa riesgo de anafilaxia.
En el contexto hipotensión relativa, el rtPA
es preferible a la SK o el APSAC. Las complicaciones
del rtPA son principalmente ocasionadas por
la lisis de placas de fibrina en lugares específicos
con daño vascular, que por la modesta reducción de
los niveles de fibrinógeno plasmáticos.
El estudio ASSET (Estudio angloescandinavo de
trombolisis temprana) fue diseñado para comparar
la administración de rtPA (100 mg durante 3
horas) combinado con un bolo de heparina i.v.(5.000
U ) seguido de infusión continua de heparina (1.000
U/hora) durante 21 horas, frente a heparina sola
para el tratamiento precoz de la sospecha de IAM.
El tratamiento combinado con rtPA y heparina se
asoció con el 26% de reducción de la mortalidad
total y 25 % en la incidencia de shock cardiogénico
durante la hospitalización, comparado con la
heparina sola no hubo diferencias significativas en
tasas de ACV, mortalidad por ACV, angina postinfarto,
ICC o reinfarto entre ambos grupos de tratamiento.
A pesar de su teórica especificidad para la fibrina
ligada al trombo, el tratamiento con rtPA no
parecía asociarse con menos complicaciones de
sangrado mayor (hematemesis, melena, hemoptisis
severa o hematuria) que aquéllas descritas para la
SK.
Un análisis por subgrupos mostró que la mejoría en la
supervivencia del rtPAse extendía a ambos sexos y se
incrementaba con el aumento de la edad.
En la práctica, el rtPAse limita a menos del 5% de los
pacientes indicando que existe una escasa convicción
acerca de los beneficios comunicados y que las
obvias limitaciones de costos ejercen un rol.
Se ha recomendado preferencia hacia el rtPA
cuando el paciente con IAM se presenta más
precozmente y el infarto es extenso, presumiendo que
la mayor tasa de reperfusión tendrá un impacto en
este subgrupo.
APSAC (Complejo anisolado SK-plasminógeno):
Este fármaco es un complejo preformado de sk y
lisina-plasminógeno humano, cuyo centro catalítico
se acetila con el objetivo de retrasar la
actividad enzimática hasta que el complejo se haya
ligado al sustrato de fibrina. La desacetilación
espontánea resulta en la reanudación de la actividad
fibrinolítica. A pesar de la modificación del
acetilo, la fibrinolisis sistémica permanece con el
APSAC. Como su compuesto emparentado, el APSAC puede
ocasionar hipotensión sistémica y respuesta
alérgica. Comparado con la SK y el rtPA, la dosis
i.v. de 30 U de APSAC requiere menos tiempo (2-5
minutos de infusión), y su vida media de eliminación
es más prolongada (90 minutos).
Se diseñó un estudio comparando la administración
de APSAC I.V. seguido de heparina I.V. frente a
heparina sola, dentro de las primeras seis horas del
IAM. Los resultados fueron los siguientes:
El estudio se terminó precozmente cuando un
análisis interno de los datos encontró que la
terapia con APSAC, se asociaba con una reducción del
47% en la mortalidad después de 30 días de
seguimiento. Los datos preliminares de la mortalidad
al año mostraron una tendencia similiar.
Un análisis por subgrupos mostró que el beneficio
en la supervivencia de la terapia con APSAC se
extendió a los grupos de mayor edad, siendo
independiente del tiempo de inicio de los síntomas.
Otros trombolíticos
Ninguna estrategia ha demostrado superioridad
respecto de la medicación con rtPA o SK, pero se
ha consolidado la utilización de reteplase como
alternativa equivalente a ambas drogas clásicas,
aunque con menor experiencia clínica.
Las ventajas de éste consisten en un efecto
trombolítico más rápido a los 90 minutos y sus
desventajas son el incremento de = 40% en la
incidencia de ACV hemorrágico y la necesidad de
anticoagulación.
TERAPIA COADYUVANTE
Aspirina: La terapia con SK sola y aspirina sola se
asociaron con una reducción significativa en el
punto final primario de la muerte vascular (muerte
por causa cardíaca, cerebral, hemorrágica o por
otra causa vascular). La combinación de SK más
aspirina fue significativamente mejor que la de
cualquiera de los dos por separado; sus efectos
parecían ser aditivos.
La terapia con aspirina sola redujo la incidencia de
reinfarto no fatal en un 50%. La terapia con SK
sola se asoció con un aumento no significativo de
la incidencia del reinfarto, el cual fue enteramente
evitado con la adición de la aspirina.
La terapia con SK sola o en combinación con
aspirina se asoció con un pequeño exceso en la
aparición de hemorragias intracerebrales, todas
ellas ocurrieron precozmente (días 0 o 1). Sin
embargo, la terapia con SK también se asoció con
la reducción significativa en la aparición de ACV
totales después del día 1º, así que el riesgo total de
ACV para el período completo de seguimiento no
se incrementó comparado con el placebo.
La reducción en la mortalidad vascular y la
mortalidad por todas las causas producidas por la
SK y la aspirina permaneció altamente significativa
(P<0,001 para cada una) después de una
mediana de seguimiento de 15 meses.
La terapia coadyuvante con aspirina en presencia
de heparina se asoció con la reducción significativa
en tasas de reoclusión tardía e isquemia
recurrente después de la trombolisis.
El beneficio de la aspirina fue casi idéntico en
pacientes que recibieron SK y aquéllos que
recibieron rtPA.
Heparina: La terapia coadyuvante con heparina ha
sido propugnada basándose en su habilidad teórica
para reducir la reoclusión mediada por trombina de
las arterias coronarias exitosamente recanalizadas.
Debido a los numerosos estudios realizados, se
concluye desde la óptica de la medicina basada en
la evidencia, que en pacientes tratados con SK y la
aspirina la adición de heparina subcutánea o
intravenosa tiene efecto muy reducido sobre la
mortalidad y la tasa de reinfarto, con incremento
significativo de los sangrados mayores y tendencia a
incremento del ACV hemorrágico. De tal manera, no se
recomienda su uso rutinario. En caso de utilizar la
heparina no fraccionada, deberá preferirse la
infusión intravenosa y ajustada de acuerdo a los
niveles de KPTT.
La heparina debe ser administrada en ciertas
situaciones clínicas específicas, tales como un
trombo ventricular izquierdo, fibrilación auricular
con ICC, isquemia recurrente, o trombosis venosa
profunda (TVP). Es justificable la utilización de
heparinas S.C. para la prevención de la TVP en los
pacientes en cama con reposo prolongado.
Desulfatohirudina recombinante (CGP-39393):
La hirudina es un anticoagulante natural obtenido
de la sanguijuela (Hirudo medicinalis).
Es un inhibidor irreversible de todas las acciones
principales de la trombina incluyendo el paso de
fibrinógeno a fibrina, la activación plaquetaria, y
la activación de la propia trombina que amplifica
sus reacciones. En modelos animales la hirudina
es superior a la heparina en la inhibición del
depósito de plaquetas y la formación de trombos.
Más aún, en modelos de trombolisis coronaria, la
hirudina acelera la trombolisis y previene la
reoclusión. Aunque las fases inciales de numerosos
estudios preveían resultados alentadores, los más
recientes y grandes estudios han sido más
desalentadores.

Inhibidores de la glicoproteína IIb/IIIa (abciximab):
Utilizados en forma individual sin trombolíticos
la tasa de reperfusión es baja y no pueden ser
recomendados. No puede asociarse a la estreptoquinasa
por incremento del riesgo de sangrado.
La adición de abciximab a media dosis de
trombolíticos sistémicos no ofrece ventajas
respecto de las estrategias convencionales en
términos de mortalidad, y la menor recurrencia
isquémica y reinfarto se ve balanceada por el
incremento de sangrados a menudo graves y el riesgo
de hemorragia intracerebral en pacientes añosos. Es
probable que esta estrategia sea una alternativa
cuando el tratamiento trombolítico se planifica para
ser continuado con una exploración hemodinámica en
agudo para constatar reperfusión y en ausencia
intentar angioplastia de rescate.
CONCLUSIONES
La aspirina es efectiva para la prevención
primaria, secundaria y durante el tratamiento
agudo del IAM.
La heparina se usa frecuentemente, con o sin
trombolisis, para mejorar la permeabilidad de las
arterias relacionadas con el infarto y para limitar
el tamaño del mismo. La terapia BB indicada
precozmente en el curso de un IAM se asocia con una
reducción significativa de la mortalidad y la
morbilidad. Estos beneficios persisten cuando los
pacientes se mantienen crónicamente con dicho
tratamiento. Para los pacientes que sufren un IAM,
la adición de un IECA oral al régimen convencional
de tratamiento, se asoció con una reducción en la
mortalidad a corto y largo plazo y en la incidencia
de fracaso progresivo de bomba. Los nitratos
utilizados conjuntamente con los IECA favorecerían a
la reducción de la mortalidad precoz posinfarto.
Los datos actuales no apoyan el uso rutinario de
los calcioantagonistas ni de alta dosis de
magnesio para el tratamiento rutinario de pacientes
con IAM. No existen datos suficientes que apoyen el
uso de lidocaína profiláctica para la supresión de
arritmias ventriculares asintomáticas, en pacientes
con IM en la fase aguda.
La terapia hipolipemiante debería ser parte
integral del tratamiento rutinario para la
prevención primaria y secundaria de la morbimortalidad
cardiovascular en pacientes con elevadas
cifras de colesterol. La terapia hipolipemiante
puede detener la progresión y promover la regresión
de la aterosclerosis establecida.
La terapia sustitutiva con estrógenos debería
considerarse para todas las mujeres postmenopáusicas,
especialmente si poseen factores de riesgo
para EC o historia de IAM previo. La adición de
progesterona es adecuada para las mujeres con útero
intacto.
En los pacientes con IAM, la restauración del
flujo anterógrado en la ARI puede salvar
miocardio y reducir la morbimortalidad. La reperfusión
aguda debe ser instaurada con prontitud para
conseguir este objetivo. Los pacientes que se
presentan dentro de las 6-12 horas del inicio de los
síntomas y que cumplen criterios ECG (elevación del
segmento ST, nuevo bloqueo de rama izquierda, o
depresión del segmento ST de V2 a V4) se benefician
claramente en términos de supervivencia de la
terapéutica trombolítica.
Las contraindicaciones absolutas para la trombolisis
incluyen la cirugía mayor, los traumatismos,
o la biopsia de órganos dentro de las seis semanas
previas, una historia de ACV hemorrágico o
indefinido: tumor intracraneal; neurocirugía previa
o traumatismo cráneoencefálico reciente; melena o
marcada hematuria; historia de diátesis hemorrágica.
Las contraindicaciones relativas a la trombolisis
incluyen: más de 10 minutos de RCP, hipertensión
severa, shock cardiogénico; ACV remoto o reciente
ataque isquémico transitorio; sangre oculta en
heces; terapéutica con warfarina concurrente. La
edad avanzada, considerada aislada, nunca será por
sí misma una contraindicación para la fibrinolisis.
Cada uno de los agentes trombolíticos estudiados
(SK, rtPA, APSAC) ha demostrado convincentemente conferir beneficios
en cuanto a la supervivencia. En general, muchos
estudios no han encontrado diferencias en cualquiera
de los tres tratamientos con respecto a la
supervivencia asociados a dosis altas de aspirina.
La aspirina a dosis plena (160-325 mg al día,
primera dosis masticada y tragada) debería
administrarse como terapia standard coadyuvante en
todos los pacientes que reciban trombolisis.
No existen datos que apoyen un beneficio
adicional de la heparina en pacientes que reciban
SK o APSAC más dosis plenas de aspirina.
La hirudina fue similar a la heparina en la eficacia
como coadyuvante de los trombolíticos. El papel
preciso de la hirudina para el tratamiento del IAM
todavía tiene que ser mejor definido.
RESUMEN Y ALGORITMO TERAPÉUTICO
Terapéutica Farmacológica Standard del IAM.
OXÍGENO a un flujo bajo de 2 a 4 L por minuto,
por mascarilla o cánula. Aunque no hay estudios
que hayan mostrado su beneficio, se lo considera
un standard de cuidado. ASPIRINA 325 mg, 1
comprimido cada 24 horas. HEPARINA, si no se puede
administrar fibrinolítico. NITRATOS, son de elección
para el dolor isquémico recurrente; disminuyen la TA
sistémica y la congestión pulmonar, sin embargo, no
deben administrarse de rutina, ya que no producen
mejoría respecto de los controles. Dinitrato
de Isosorbide 5 mg sublingual, cada 10 minutos,
hasta que ceda el dolor (generalmente de 2 o 3
comprimidos); si no cede, dar opioides. O sino:
Goteo de Nitroglicerina, ampollas con 25 mg/ 5
mL, diluir en 250 mL de Dextrosa 5% (dosis: 20 a
200 gammas/minuto; habitual 25 a 50 gammas
/minuto) y comenzar a 15 microgotas por minuto ( 25
gammas).
Regular hasta el control de los síntomas, tratando
de mantener la TAmedia por encima de 80 mmHg
o la sistólica por encima de 90 mmHg; la frecuencia
cardíaca deberá mantenerse a no más de 20% de basal.
Luego pasar a:
Mononitrato de Isororbide, administrar 1
comprimido en el horario de las 07, 13, 19 horas,
para permitir doce horas de descanso y evitar la
taquifilaxia. BETABLOQUENTES, están
contraindicados si hay fallo de bomba; reducen el
dolor isquémico y la incidencia de fibrilación
ventricular, con lo cual disminuye un 15% la
mortalidad.
Atenolol comprimidos, administrar 25-50 mg
cada 12 horas.
O sino:
Propranolol comprimidos, administrar 20-40 mg
cada 6-8 horas. Con los beta bloqueantes se debe
procurar una frecuencia cardíaca inferior a 60 por
minuto.
INHIBIDORES de la ECA, el sistema renina
angiotensina se puede activar en diferentes
situaciones de isquemia miocárdica, y ésta sería la
base del uso de los IECA en pacientes con enfermedad
coronaria aguda y crónica; con un IAM de cualquier
localización y con disfunción ventricular izquierda
asintomática (FE < 40%), está demostrado que la
administración de
Captopril, reduce en un 21% el riesgo global de
mortalidad cardiovascular a los 5 años. El
Ramipril en pacientes con IAM y signos clínicos de
insuficiencia cardíaca, ha demostrado también su
beneficio al reducir la mortalidad un 27% sobre todo
transcurrido el primer año de evolución y hasta el
cuarto de seguimiento.
Enalapril 2,5-5-10 y 20 mg,
administrar entre 2,5 y 15 mg por día.
Ramipril 1,25-2,5 y 5 mg, administrar entre 2,5 a
5 mg por día
Captopril,1 comprimido por día.
BLOQUEANTES CÁLCICOS se debe estar
atento a la aparición de bradicardia, o de
taquicardia refleja, o de bloqueo aurículo ventricular
o de depresión miorcárdica. Son de elección
en los pacientes con IAM no-Q, ya que previenen el
infarto o la isquemia. Se los considera de segunda o
tercera elección en hipertensos o isquémico, luego
de los nitratos y beta bloqueantes.
Diltiazem comprimidos de 60-90- 120 mg, administrarlo
cada 6 a 8 horas y luego pasarlo a
comprimidos AP de 120-180 mg cada 12 horas.
Verapamil, a una dosis de 240-360 mg por día.
Terapéutica Trombolítica en el IAM
Indicaciones Dolor torácico de 1 a 3
horas de iniciado: reducen más de 50% la mortalidad.
Dolor torácico de menos de 12 horas, reducen
más de 10% la mortalidad. ST/T elevado, ondas
Q o Bloqueos de rama dentro de las 6-12 horas.
Infartos grandes (anteriores o mulifocales) tienen
gran beneficio, al contrario de los IAM no Q, que
no se benefician, porque se recanalizan parcialmente
en forma espontánea.
Contraindicaciones
Diátesis hemorrágica comprobada - Hemorragia
digestiva reciente, ACV reciente (dentro de los
dos meses) - TA>190/110 - Traumatismo de
cráneo dentro de los 2 meses previos, sin TAC que
descarte subdural - Cirugía reciente de cabeza o
columna - Cirugía mayor dentro de los 2 meses
previos - Embarazo - Endocarditis infecciosa -
Reanimación de paro cardíaco mayor a 10 minutos -
Sospecha de aneurisma disecante - Retinopatía
hemorrágica - Tratamiento previo con fibrinolíticos
(dentro de los últimos 6 meses) - Edad mayor de 80
años - Cateterismo cardíaco reciente - Insuficiencia
hepática o renal severa - Punciones venosas o
arterial de vasos no comprimibles dentro del último
mes.
Técnicas
No se necesita realizar test de anticoagulación,
porque las dosis son fijas. Para administrarlos,
preferir accesos periféricos (Abocath o Venocath), y
si es posible no canalizar ni hacer punción central.
Activador tisular del plasminógeno recombinante
(rtPA) (Fco. ampolla 50 mg, diluyente 50
mL). Es única opción si ya recibió estreptokinasa
o ureasa en otro episodio. Utilizar 2 frascos de
rtPA 100 mL= 100 mg. Se administran 10 mL
directamente en bolo, en 2 minutos; los restantes 90
mL se diluyen en 110 mL de solución fisiológica, y
se perfunden en 120 minutos.
Dar Aspirina 325 mg, masticar y deglutir en el
acto: luego cada 24 hs. y luego administrar
Heparina 15 Ul/Kg/hora, por no menos 24 horas.
Este fibrinolítico está contraindicado en mayores
de 70 años que sean hipertensos, porque aumenta
incidencia de hemorragia intracerebral.
Estreptokinasa ( fco. c/250.000 y c/1.500.000 UI)
1. Hidrocortisona 500 mg IV rápido (disminuye
alergia fibrinolítico)
2. Estreptokinasa 1 frasco de 250.000 UI en 100
mL de solución fisiológica durante 20 a 30
minutos, seguidos de 250.000 UI en 500 mL de
solución fisiológica a pasar en 24 horas.
3. Con este fibrinolítico no está demostrada la
utilidad de administrar Heparina luego del mismo. Es
de elección en más de 65 años.
Complejo activador plasminógeno estreptokinasa
(Anistreplasa, APSAC) (no se comercia en
Argentina)
Se administra en bolo, y se concentra en el
trombo, activándose localmente en 90 minutos.
Es de elección para ser administrada fuera del
hospital, o en una sala de emergencias muy atareada.
Luego de administrar los trombolíticos, se deberá
continuar con heparina a la dosis indicada más
arriba (no en el caso de rtPA), durante 24 a 48
horas.
Tratamientos sintomáticos coadyuvantes
Si hay CEFALEA: administrar DIPIRONA, o
DICLOFENAC.
Si hay ANSIEDAD: dar LORAZEPAN 1 mg,
cada 12 horas.
Si hay ACIDEZ: dar OMEPRAZOL 40 mg
ampolla o comprimidos.
La Morfina es un poderoso analgésico, que también
tiene efecto vasodilatador. Su uso debería limitarse a
aquellos enfermos que continúan con dolor a pesar de
los nitratos y beta bloqueantes. La literatura que
apoye su uso es escasa.
ABREVIATURAS UTILIZADAS
I.A.M.: Infarto agudo de miocardio.
I.M. : Infarto de miocardio.
A.A.S.: Ácido acetil salicílico.
I.V.: Intravenoso.
S.C.: Subcutáneo.
A.C.V.: Accidente cerebro vascular.
B.B.: Betabloqueates.
I.C.C.: Insuficiencia cardíaca congestiva.
I.E.C.A.: Inhibidores de la enzima convertidora de
la angiotensina.
N.T.G.: Nitroglicerina.
V.I.: Ventrículo izquierdo.
E.V.: Complejos ventriculares prematuros.
F.V.: Fibrilación ventricular.
E.C.: Enfermedad coronaria.
A.C.T.P.: Angioplastia coroaria transluminal
percutánea.
S.K.: Estreptoquinasa.
rtPA: Activador tisular de plasminógeno.
APSAC: Complejo anisolado estreptoquinasa -plasminógeno.
IC: Intervalo de confianza.
RCP: Resucitación cardiopulmonar.
BIBLIOGRAFIA
1. Doval, Tajer. Evidencias en Cardiología II. De Los
Ensayos Clínicos a las Conductas Terapéuticas. 2º
Edic. Cap. 9; 2001: 175- 206.
2. Barrero, Piombo. El Paciente En La Unidad Coronaria. 1ª
Edic. Cap. 3, 1998: 29-52.
3. ACC/AHA Guidelines for the Management of Patients with a
Acute Myocardial Infarction. A Report of the American College of
Cardiology/American Heart Association Task Force on Practice
Guidelines (Committee of Management of Acute Myocardial
Infarction)J. Am Coll Cardiol. 1996; 28: 1328.
4.Fibriolytic Therapy Trialists (FTT) Collaborative Group.
Indications for fibrinolytic therapy in suspected acute myocardial
infarction: collaborative overview of early mortality and major
morbidity results from all randomised trials of more than 1000
patients. Lancet 1994; 343:311.
5.Indication for ACE inhibitors in the Early Treatment of
Acute Myocardial Infarction. Overview of individual
data from 100.000 patients in randomized trials.
1998; 97: 2202-2212.
6.Lee BW, Hsu SI, Stasior Ds. Medicina Basada En La
Evidencia Massachussets General Hospital. Madrid
1999; 119-134.
7.Cengarle C.R. Sugerencias Terapéuticas Normalizadas Y Por
Algoritmos, 3ª Edic., Vol. 5, 2002; 34-39.
8.Ventricular Dysfunction And The Risk Of Stroke After
Myocardial Infarction. J. Med 1997; 336: 251-7.
9.Holbrook J.H. y col. American College Of Physicians,
Medicina Cardiovascular (I), Vol 1 Nº 2, 1999; 7-11.
10. Grodstein. Postmenospausal estrogen and progrestin use
and the risk of cardiovascular disease. N. Engl J.
Med 1996; 335:453.
11.Shepherd. Prevention of coronary heart disease with
pravastatin in men with hypercholesterolemia. N.
Engl J. Med 1995; 333:1301.
12.Scandinavian Simvastatin Study Group. Randomized trial
of cholesterol lowering in 4444 patients with
coronary heart disease: the Scandinavian Simvastatin
Survival Study (4S). Lancet 1994; 334:1383
13.García Orta R., Moreno Escobar E. Manual De Urgencias.
Cap.3,1999; 28-34.
14.Rogers. Treatment of myocardial infarction in the United
Status (1990-1993). Circulation 1994; 90:2103.
15.Hirschson Prado A, Trivi M. Tajer C y col. Infarto agudo
de miocardio en la Argentina. Tercera Encuesta
Nacional SAC 1996. Rev. Argent Cardiol 1998; 66:
63-72. |

